
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 ①汽油中不含氮元素;
②同位素之间的变化是物理变化;
③天然气、煤气都是可燃性的气体,当达到爆炸限度后,遇到明火会发生爆炸;
④三价铁离子水解生成氢氧化铁胶体,具有吸附性;
⑤糖有单糖、低聚糖、多糖.淀粉、纤维素、蛋白质等是天然高分子化合物.
解答 解:①汽油中不含氮元素,汽车尾气中的氮氧化物是空气中的氮气与氧气在高温下生成的,故错误;
②同位素之间的变化是物理变化,故错误;
③天然气、煤气都是可燃性的气体,当达到爆炸限度后,遇到明火会发生爆炸,故正确;
④三价铁离子水解生成氢氧化铁胶体,具有吸附性,能够净水,不能杀菌消毒,故错误;
⑤糖中单糖、低聚糖不是高分子化合物,多糖是高分子化合物,蛋白质是天然高分子化合物,故错误;
故选:C.
点评 本题考为综合题,考查了生活中的化学,熟悉汽油的成分、物理变化与化学变化的区别、胶体的性质、高分子化合物的概念即可解答,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
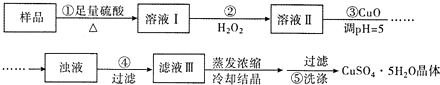
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最外层电子数:Y>W | D. | Y、z的氧化物都是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  称取NaOH固体 | B. | 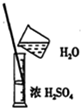 稀释浓硫酸 | ||
| C. | 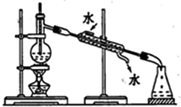 分离乙醇和水混合物 | D. | 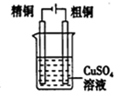 电解炼制铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;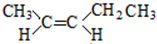 、和
、和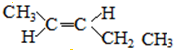 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
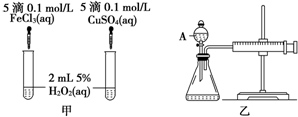 (1)下列反应属于吸热反应的是DE
(1)下列反应属于吸热反应的是DE查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com