
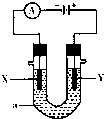
 如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 11.2L |
| 22.4L/mol |
| ||
| ||
| 3.2g |
| 64g/mol |
| ||
| ||
| 11.2L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| Cl2 |
| 催化剂 |
| Cl-R′ |
| △ |

| Br2 |
| CCl4 |
| H+ |
| KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2(CuO) |
| B、NaOH(Na2O) |
| C、NaCl(NaCl) |
| D、H2SO4(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
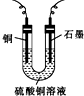 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: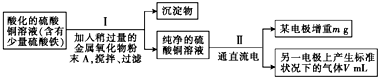
查看答案和解析>>
科目:高中化学 来源: 题型:
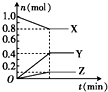 如图曲线表示在2L密闭容器中,反应aX(g)?bY(g)+cZ(g)中各物质的物质的量随时间变化的关系,则该反应的化学方程式为( )
如图曲线表示在2L密闭容器中,反应aX(g)?bY(g)+cZ(g)中各物质的物质的量随时间变化的关系,则该反应的化学方程式为( )| A、X?Y+Z |
| B、X?2Y+Z |
| C、2X?2Y+Z |
| D、2X?4Y+Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
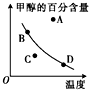 某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=
某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 表一 | ||
| T/℃ | 400 | 500 |
| K | 32 | 44 |
| 表二 | |||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量浓度(mol?L-1) | 0.54 | 0.68 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 精制 |
| 电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
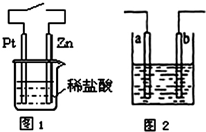
| A、与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| B、用电解法提取氯化铜废液中的铜,可以用碳棒连接电源的正极,另一电极用铜片 |
| C、图1中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D、图2所示装置可发生反应的离子方程式为Zn+2H+=Zn2++H2↑,且a、b电极不可能是同种材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com