
【题目】利用所学知识,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
请回答下列问题:
(1)E中含有的官能团名称为____________;D的结构简式为________________
(2)④的反应类型为___________________。
(3)写出反应⑦的化学方程式______________________________________。
(4)![]() 的同分异构体中,能与NaHCO3溶液反应产生气泡的有__________种。
的同分异构体中,能与NaHCO3溶液反应产生气泡的有__________种。
(5)写出反应③的化学方程式______________________________
【答案】 碳碳双键、溴原子 ![]() 消去反应
消去反应 ![]() 8
8 
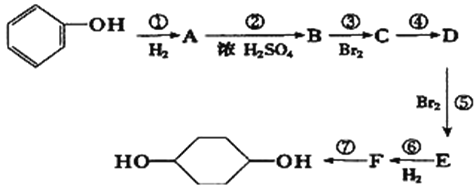
【解析】由题中合成路线可知,苯酚经催化加氢后生成A,则A为环己醇;A与浓硫酸发生消去反应生成B,则B为环己烯;B与溴发生加成反应生成C,则C为1,2-二溴环己烷;C再发生消去反应生成D,则D为1,3-环己二烯;D与溴发生1,4-加成反应生成E;E与氢气发生加成反应生成F,F为1,4-二溴环己烷;最后,F发生水解反应生成1,4-环己二醇。
(1)E中含有的官能团名称为碳碳双键、溴原子;D的结构简式为![]() 。
。
(2)④的反应类型为消去反应。
(3)反应⑦的化学方程式为![]() 。
。
(4)![]() 的同分异构体中,能与NaHCO3溶液反应产生气泡的分子中有羧基,该有机物可能有CH3CH2CH2CH2CH2COOH、CH3CH(CH3)CH2CH2COOH、CH3 CH2CH(CH3)CH2COOH、CH3 CH2CH2CH(CH3)COOH、CH3 CH2CH(CH2CH3)COOH、CH3C(CH3)2CH2COOH、CH3 CH2C(CH3)2COOH 、CH3CH(CH3)CH(CH3)COOH 等8种。
的同分异构体中,能与NaHCO3溶液反应产生气泡的分子中有羧基,该有机物可能有CH3CH2CH2CH2CH2COOH、CH3CH(CH3)CH2CH2COOH、CH3 CH2CH(CH3)CH2COOH、CH3 CH2CH2CH(CH3)COOH、CH3 CH2CH(CH2CH3)COOH、CH3C(CH3)2CH2COOH、CH3 CH2C(CH3)2COOH 、CH3CH(CH3)CH(CH3)COOH 等8种。
(5)反应③的化学方程式为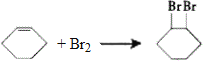 。
。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)化合物D中所含官能团的名称为__________________和_____________________。
(2)化合物E的结构简式为__________________;由B→C的反应类型是____________。
(3)写出C→D的反应方程式____________________________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有_____种。
I.属于芳香族化合物
II.能发生银镜反应
III.其核磁共振氢谱有5组波峰,且面积比为1:1:1:1:3
(5)请写出以甲苯为原料制备化合物![]() 的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图____(无机试剂可任选)。合成路线流程图示例如图:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol/L、体积分别为Va 和Vb 的HA溶液与BOH溶液按不同体积比混合,保持Va + Vb = 100 mL, Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是
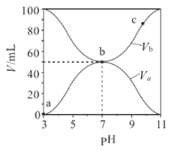
A. Ka(HA)=Kb(BOH)=10-5
B. b点时, c(B+)=c(A-)≠c(H+)=c(OH-)
C. c点时, 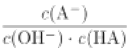 随温度升高不变
随温度升高不变
D. a→c过程中水的电离程度先增大后减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H______(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

① 该反应化学平衡常数K的表达式是____________________。
②0~9min时间内,该反应的平均反应速率ν(H2) =_______。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图所示,L和X分别表示温度或压强。

i. X表示的物理量是:_____________。
ii. 判断L1与L2的大小关系,并简述理由:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Fe3+有氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | SO2有漂白性 | SO2可使溴水褪色 |
D | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
Fe2O3(s)+![]() CO(g)===
CO(g)=== ![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) ΔH=-15.73 kJ/mol
CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
则42 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A. +218 kJ/mol B. +327 kJ/mol C. -218 kJ/mol D. -327 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是。
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.3 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )

A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe →Fe2++2e-
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com