
| t/s | 0 | 5 | 15 | 25 | 35 | ||
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 | ||
| A. | 前 5 s 的平均反应速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 正反应是吸热反应 | |
| C. | 保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80% | |
| D. | 保持温度不变,起始时向容器中充入0.2molA、0.2molB?和1molC,反应达到平衡前v(正)<v(逆) |
分析 向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,由表格数据可知25s达到平衡,则
A(g)+B(g)=C(g)
开始 0.5 0.5 0
转化 0.1 0.1 0.1
平衡 0.4 0.4 0.1
A.结合v=$\frac{△c}{△t}$计算;
B.由信息不能判断反应中能量变化;
C.保持温度不变,起始时向容器中充入2molC,极性转化为反应物,与原起始量相同;
D.K=$\frac{0.1}{0.4×0.4}$=0.625,Qc=$\frac{0.5}{0.1×0.1}$=50,Qc>K,平衡逆向移动.
解答 解:向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,由表格数据可知25s达到平衡,则
A(g)+B(g)=C(g)
开始 0.5 0.5 0
转化 0.1 0.1 0.1
平衡 0.4 0.4 0.1
A.前 5 s 的平均反应速率v(A)=$\frac{\frac{1mol-0.85mol}{2L}}{5min}$=0.015 mol•L-1•s-1,故A错误;
B.由信息不能判断反应中能量变化,不能确定是否为吸热、放热反应,故B错误;
C.保持温度不变,起始时向容器中充入2molC,极性转化为反应物,与原起始量相同,原平衡时A的转化率为$\frac{0.1}{0.5}$×100%=20%,则起始时向容器中充入2molC,达平衡时,C的转化率为80%,故C错误;
D.K=$\frac{0.1}{0.4×0.4}$=0.625,Qc=$\frac{0.5}{0.1×0.1}$=50,Qc>K,平衡逆向移动,则反应达到平衡前v(正)<v(逆),故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及速率计算为解答的关键,侧重分析与计算能力的考查,注意选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 | |
| B. | 大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| C. | 大量燃烧化石燃料排放的废气中含有大量SO2,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅元素在自然界里均以化合态存在 | |
| B. | SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2=Si+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?263 | B. | +263 | C. | ?352.1 | D. | +131.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
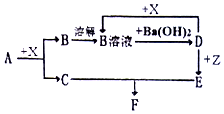 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
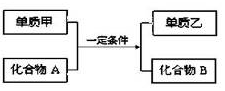
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL | B. | 5 mL | C. | 大于5 mL | D. | 小于5 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com