
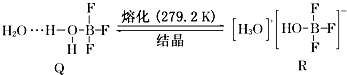
分析 (1)非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,无金属单质,所以无金属键;
(2)根据价层电子对互斥理论确定H3O+空间构型、阴离子中中心原子杂化方式.
解答 解:(1)非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的H原子易形成氢键,所以不涉及的是离子键和金属键,故选:a、d;
(2)H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,
故答案为:三角锥形;sp3.
点评 本题考查了粒子空间构型的判断、原子杂化方式的判断,化学键等知识点,这些知识点都是高考高频点,根据价层电子对互斥理论、元素周期律等知识点来分析解答即可.


科目:高中化学 来源: 题型:填空题
 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是Mg2+、Al3+、NH4+,它们的物质的量浓度之比为c(Mg2+):c(Al3+):c(NH4+)=1:1:3,所加淡黄色固体是Na2O2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:$NH_4^+、N{a^+}、F{e^{3+}}、SO_4^{2-}$ | |
| B. | 含有大量$AlO_2^-$的溶液中:$N{a^+}、{K^+}、HCO_3^-、NO_3^-$ | |
| C. | 中性溶液中:${K^+}、A{l^{3+}}、C{l^-}、SO_4^{2-}$ | |
| D. | Na2S溶液中:$SO_4^{2-}、{K^+}、C{u^{2+}}、C{l^-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com