
【题目】在100℃时,将0.2molN2O4(g)充入2L的恒容密闭容器中,间隔一定时间后对该容器内各物质的物质的量进行测定,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
N(N2O4)/mol | 0.20 | n1 | 0.10 | n3 | n4 |
N(NO2)/mol | 0.00 | 0.12 | n2 | 0.24 | 0.24 |
(1)该反应的平衡常数表达式为___________________________,由表中数据分析可得,n1=____mol,n3=________________mol;
(2)在上述条件下,从0到40s内NO2的平均反应速率为___________________;
(3)该反应达到化学平衡后,下列改变可使N2O4浓度增大的是_____(填序号);
A.增大容器的容积 B.向容器中充入一定量的NO2
C.向容器中再充入一定量的N2O4 D.向容器中充入一定量的He(g)
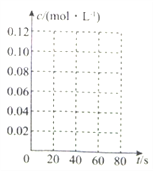
(4)在下图中画出此反应中N2O4的浓度随时间变化的曲线_________。
【答案】K=c2(NO2)/c(N2O4) 0.14 0.08 0.00 5 mol·L-1·s-l BC 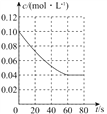
【解析】
(1)该可逆反应的方程式为N2O4(g) ![]() 2 NO2(g),平衡常数表达式为K=c2(NO2)/c(N2O4);由表中数据看出,0-20s内, n(NO2)变化了0.12 mol,则n(N2O4)变化了0.06 mol,剩余n(N2O4)=0.2-0.06=0.14 mol;0-60s内,n(NO2)变化了0.24 mol,n(N2O4)变化了0.12mol,则n(NO2)剩余0.2 -0.12=0.08mol,正确答案:. K=c2(NO2)/c(N2O4); 0.14 ; 0.08。
2 NO2(g),平衡常数表达式为K=c2(NO2)/c(N2O4);由表中数据看出,0-20s内, n(NO2)变化了0.12 mol,则n(N2O4)变化了0.06 mol,剩余n(N2O4)=0.2-0.06=0.14 mol;0-60s内,n(NO2)变化了0.24 mol,n(N2O4)变化了0.12mol,则n(NO2)剩余0.2 -0.12=0.08mol,正确答案:. K=c2(NO2)/c(N2O4); 0.14 ; 0.08。
(2) 0到40s内,n(N2O4)变化了0.1mol,则n(NO2)变化了0.2 mol,NO2的平均反应速率为0.2÷2÷40=0.00 5 mol·L-1·s-1,正确答案:0.00 5 mol·L-1·s-1。
(3)该反应达到化学平衡后,增大容器的容积,相当于减压,平衡向右移动,N2O4浓度减少,A错误;向容器中充入一定量的NO2,平衡向左移动,N2O4浓度增大,B正确;向容器中再充入一定量的N2O4 ,相当于加压,平衡左移,N2O4浓度增大,C正确;向容器中充入一定量的He(g),对各物质浓度无影响,对平衡无影响,D错误;正确选项BC。
(4) 2L的恒容密闭容器发生N2O4(g) ![]() 2 NO2(g),起始时,c(N2O4)=0.10 mol·L-1,随着反应的进行,c(N2O4)不断减少,进行到60s后,反应达平衡状态,n3=0.08 mol,剩余c(N2O4)=0.04 mol·L-1,据以上分析就可以画出N2O4的浓度随时间变化的曲线,正确答案:
2 NO2(g),起始时,c(N2O4)=0.10 mol·L-1,随着反应的进行,c(N2O4)不断减少,进行到60s后,反应达平衡状态,n3=0.08 mol,剩余c(N2O4)=0.04 mol·L-1,据以上分析就可以画出N2O4的浓度随时间变化的曲线,正确答案:


科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含砷(As)的有毒工业废水经下图流醒转化为粗As2O3,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
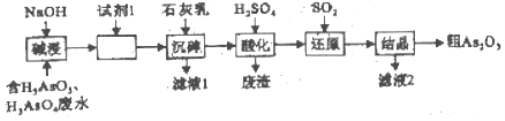
(1)砷是氮的同族元素,且比氮多2个电子层,则AsH3的电子式为_____。
(2)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的离子方程式为_____。
(3)加入试剂1的目的是_____。
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
A.Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)△H<0
B.5Ca2++OH﹣+3AsO43﹣Ca5(AsO4)3OH△H>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要用逾。
(1)基态磷原子价电子排布的轨道表示式为_____。
(2)元素B、N、O的第一电离能由大到小的顺序为_____。
(3)一种食品添加剂NaNO2中NO2﹣中心原子的杂化类型是_____,与NO2﹣互为等电子体的分子的化学式为_____(写1种)
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是_____。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_____,三溴化硼键角是_____。
②磷化硼晶体晶胞如图所示,其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为_____,磷原子的配位数为是_____,该结构中有一个配位健,提供空轨道的原子是_____;已知该晶胞边长apm,阿伏加德罗常数为NA,则磷化硼晶体的密度为_____gcm﹣3。
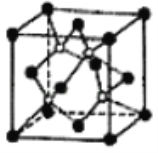
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A. 将过量氨气通入CuSO4溶液中可得深蓝色溶液
B. 蛋白质溶于水所得分散系可产生丁达尔效应
C. 硅酸钠溶液与稀盐酸反应可生成硅酸胶体
D. 过量铁粉在氯气中燃烧可生成氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向盛有1 L 0.1 mol·L-1NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
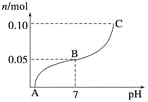
A. A点时pH=1
B. 恰好完全沉淀时Ba(OH)2的体积为2 L
C. B点时,溶液中的离子浓度关系为c(Na+)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
D. C点时pH=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是
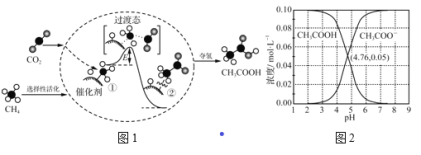
A. CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B. 中间体①的能量大于中间体②的能量
C. 室温下,CH3COOH的电离常数Ka=10-4.76
D. 升高温度,图2中两条曲线交点会向pH增大方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为___________;第二周期的元素中,第一电离能介于B和N之间的元素有___________种。
(2)雌黄的分子式为As2S3,其分子结构如图所示:![]() As原子的杂化类型为___________。
As原子的杂化类型为___________。
(3)①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为___________;[Cu(NH3)4]SO4·H2O固体中含有的化学键有___________(填标号)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行___________实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是___________。
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O分子中的大π键表示为_________________。
。N2O分子中的大π键表示为_________________。
(5)立方氮化硼晶胞如图,其密度为ρg/cm3,氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,硼原子的半径为r cm,则硼原子的空间占有率为____________________(用含有ρ、M、NA、r的代数式表示)。
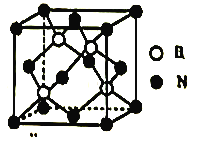
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com