
| A. | △H>0 kJ/mol表示放热反应,△H<0 kJ/mol表示吸热反应 | |
| B. | 热化学方程式中的化学计量数表示物质的量,所以不可以是分数 | |
| C. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| D. | 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的状态 |
分析 A.放热△H为负,吸热△H为正;
B、热化学方程式中的化学计量数表示物质的量,能为分数;
C、热化学方程式中,如果没有注明温度和压强,则表示在通常标准状况下测得的数据;
D、根据书写热化学方程式的书写方法分析.
解答 解:A.放热△H为负,吸热△H为正,故A错误;
B、热化学方程式中的化学计量数表示物质的量,不表示分子数,所以能为分数,故B错误;
C、热化学方程式中,如果没有注明温度和压强,则表示在通常状况下测得的数据,不是标准状况,故C错误;
D、书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态,故D正确;
故选D.
点评 本题考查了热化学方程式书写及意义,要理解系数的含义,书写方法,掌握基础是关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 石蕊试液 | ||
| C. | 新制Cu(OH)2 悬浊液 | D. | Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层结构相同的粒子随核电荷的递增半径逐渐增大 | |
| B. | CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 | |
| C. | S2-半径小于硫原子半径 | |
| D. | 无法比较K+、Al3+、O2-、Cl-的半径大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


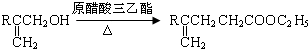
 .
.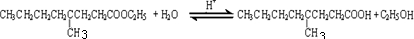 .
.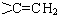 的同分异构体有12种.
的同分异构体有12种.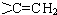 ,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为
,核磁共振氢谱有3个峰,且峰面积之比为9:2:1的同分异构体的结构简式为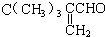 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾天气仅影响出行能见度,对人体健康没有影响 | |
| B. | 减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施 | |
| C. | 当光束分别通过雾霾和豆浆时,仅豆浆可看到一条光亮的“通路” | |
| D. | 气候环境报告中新增的“PM2.5”就是雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物有两种 | |
| B. | 气态氢化物稳定性:丙>丁 | |
| C. | 丙的氧化物能与戊的氢化物的水溶液反应 | |
| D. | 原子半径大小:甲>丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com