
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |
分析 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生,则Y为正极、X为负极,则金属性:X>Y;将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈,则金属性:W>X;用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z,金属性越弱越容易析出,则金属性:Y>Z,则金属性强弱为:W>X>Y>Z,据此对各选项进行判断.
解答 解:将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生,则Y为正极、X为负极,则金属性:X>Y;将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈,则金属性:W>X;用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z,金属性越弱越容易析出,则金属性:Y>Z,则金属性强弱为:W>X>Y>Z,
A.根据分析可知,Z的还原性最弱,故A正确;
B.金属性强弱为:W>X>Y>Z,则还原性W的强于Y,故B正确;
C.若Z为银或铜,Z放人CuSO4溶液中不会Cu析出,故C错误;
D.由于金属性强弱为:X>Z,则X较活泼,二者构成的原电池中X为负极,故D正确;
故选C.
点评 本题考查了金属活动性强弱及应用,题目难度中等,涉及原电池原理、电解原理及金属性强弱判断等知识,注意掌握判断金属性强弱的常用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
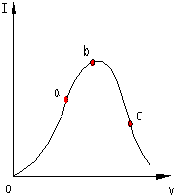 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属及其化合物有广泛的应用.
金属及其化合物有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②③⑤ | C. | ②③ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
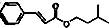 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: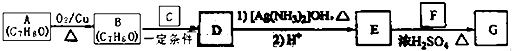 已知以下信息:
已知以下信息: ;
; +CH3CHO$\stackrel{一定条件}{→}$
+CH3CHO$\stackrel{一定条件}{→}$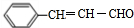 +H2O.
+H2O. +(CH3)2CHCH2CH2OH$→_{△}^{浓硫酸}$
+(CH3)2CHCH2CH2OH$→_{△}^{浓硫酸}$ +H2O,反应类型为酯化反应.
+H2O,反应类型为酯化反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com