

| 2 | ||
|
| m |
| 0.3 |
 ,
, ;
; ,Na2S溶液在空气中变质过程的化学方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,
,Na2S溶液在空气中变质过程的化学方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2, ;4Na2S+O2+2H2O═4NaOH+2Na2S2;
;4Na2S+O2+2H2O═4NaOH+2Na2S2;| 2 | ||
|
| m |
| 0.3 |
| ||
| a |
| 56 |
| ||
| a |
| 56 |


科目:高中化学 来源: 题型:
| A、A2BC4 |
| B、A2B2C4 |
| C、A2BC3 |
| D、A4BC4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表共有7个周期,其中3个长周期,4个短周期 |
| B、元素周期表共有16个纵行,其中7个主族,7个副族,1个零族,1个第Ⅷ族 |
| C、12C、13C、14C分别是碳元素的3种核素,互称为同位素 |
| D、1H、2H、3H三种核素的质子数相同,中子数不同,属于3种不同元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 空气含量最多的元素 |
| Y | 3p能级只有一个电子 |
| Z | 单质用于制造集成电路和太阳能板的主要原料 |
| W | 常见化合价有+2、+3,其中一种氧化物为红褐色 |
| 离子半径 | 电负性 | 第一电离能 | 单质熔点 |
| X | Z | X | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28gCO和N2的混合气体中含有原子总数为2NA |
| B、常温常压下,2g氢气所含原子数目为2NA |
| C、标准状况下,足量Fe与22.4LCl2反应,转移电子数为2NA |
| D、0.1mol/LNa2CO3溶液中含有的Na+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Na<Mg<C<N |
| B、热稳定性:HI<HBr<HCl<HF |
| C、最高正化合价:Si<P<S<Cl |
| D、碱性:Al(OH)3>Mg(OH)2>Ca(OH)2>KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯与氧气在银催化作用下生成环氧乙烷 |
| B、乙烷与氯气反应制备氯乙烷 |
| C、苯与乙醇在一定条件下生产乙苯 |
| D、乙醇与浓硫酸共热制备乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
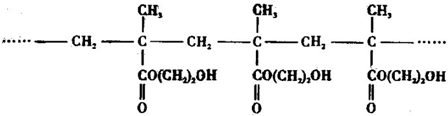

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com