
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
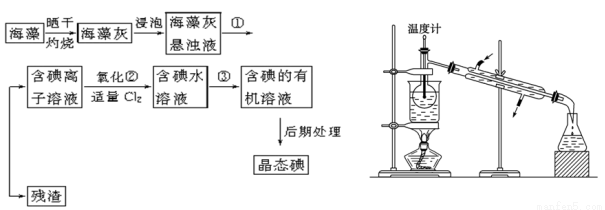
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A.苯 B.四氯化碳 C.酒精 D.醋酸
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是 。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
① 。
② 。
③ 。
(5)进行上述蒸馏操作时使用水浴的原因是 。
(6)四氯化碳是____色液体。如果本实验用苯做萃取剂,则上层液体的颜色为 色,下层液体中溶质的主要成分为___________(写化学式)。
科目:高中化学 来源:2015-2016学年云南云天化中学高二12月月考理化学试卷(解析版) 题型:选择题
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为
A.84% B.60% C.91% D.42%
查看答案和解析>>
科目:高中化学 来源:2016届辽宁葫芦岛第一高级中学高三上期中考试化学试卷(解析版) 题型:选择题
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
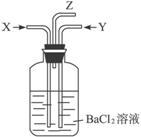
A、在Z导管口有红棕色气体出现
B、洗气瓶中产生的沉淀是 和
和 的混合物
的混合物
C、洗气瓶中产生的沉淀是
D、在Z导管出来的气体中无
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:填空题
化学是一门以实验为基础的自然科学,右图为某试剂瓶上的标签,试回答下列问题。

(1)该盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述较浓盐酸和蒸馏水配制500 mL物质的量浓度为0.150 mol·L-1的稀盐酸。
①该学生需要量取________mL上述较浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏小”,填B表示“偏大”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面( )。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )。
c.配溶液用的容量瓶用蒸馏水洗涤后未经干燥( )。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高二上期中考试化学试卷(解析版) 题型:选择题
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、CO32-、HCO3-、Br-等离子。火力发电燃煤排放的含有SO2的烟气可利用海水脱硫,其工艺流程如下所示:

下列说法错误的是:
A.含SO2的烟气若不经过海水脱硫直接排放可造成酸性降雨
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:推断题
部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
电离平 衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
(1)请写出HNO2的电离方程式 。
(2)上表的5种酸进行比较,酸性最弱的是:_______________;HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是 。
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH—先后消耗的酸及酸式酸根依次是:_______________________。
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:__________________。
(5)下列离子方程式书写正确的是 。
A.HNO2 + HS— == NO2—+ H2S↑
B.2HCOOH+SO32— == 2HCOO—+H2O+SO2↑
C.H2SO3+2HCOO— == 2HCOOH+SO32—
D.H2SO3+ SO3 2— == 2HSO3—
E.H2C2O4+ NO2—== HC2O4—+ HNO2
(6)已知HX为一元弱酸。某混合溶液中含有4mol NaX、2mol Na2CO3和1mol NaHCO3。往溶液中通入3mol CO2气体,充分反应后,气体全部被吸收,计算某些物质的量:
Na2CO3 _。NaHCO3 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北荆州中学高一上学期期中考试化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Ag+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:实验题
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放250 mL足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加了8 g。常温下各烧杯中溶液的pH与电解时间t的关系图如下。据此回答下列问题:
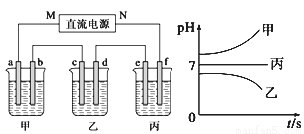
(1)M为电源的________极(填写“正”或“负”)。
(2)计算电极e上生成的气体在标准状况下的体积为_________________。
(3)B溶液中的溶质为 。电解后,乙烧杯中溶液的pH=__________。 若在B溶液中事先滴加紫色石蕊试液, 极(填写“c”或“d”)先变红。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京顺义牛栏山一中高一上期中化学试卷(解析版) 题型:选择题
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:
① 2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O
② Na2FeO4 + 2KOH == K2FeO4 + 2NaOH
下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中NaClO 是氧化剂
C.Na2FeO4 中Fe为+4价,具有强氧化性,能杀菌消毒
D.若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com