
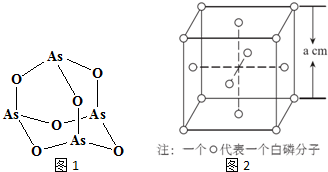
分析 (1)As原子核外电子数为33,根据能量最低原理书写核外电子排布式;
(2)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的;
(3)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;
(4)Na3AsO4属于离子化合物,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,据此判断空间构型;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;
(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成;
(6)根据均摊法可知,晶胞中P4分子数目为4,则晶胞中含有16个P原子,计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)P的3p亚层是半充满状态,比较稳定,第一电离能高于同周期相邻元素的,第一电离能大于硫的,
故答案为:P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大;
(3)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H的键角比NH3中H-N-H的键角大,
故答案为:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力;
(4)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,
故答案为:离子键、共价键;正四面体;sp3;
(5)化合物NH5中的所有原子最外层都满足稳定结构,则由铵根离子与氢负离子构成,属于离子晶体,故答案为:离子;
(6)根据均摊法可知,晶胞中P4分子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞中P原子数目为4×4=16,晶胞质量为16×$\frac{31}{{N}_{A}}$g,晶胞体积为(a cm)3,则晶胞密度为$\frac{4×\frac{31}{{N}_{A}}g}{(acm)^{3}}$=$\frac{496}{{a}^{3}{N}_{A}}$g.cm-3,
故答案为:$\frac{496}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、价层电子对互斥联立、杂化方式与空间构型判断、化学键、晶胞计算等,是对物质结构主干知识的考查,需要学生具备扎实的基础与灵活运用能力,难度中等,掌握均摊法进行有关晶胞计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
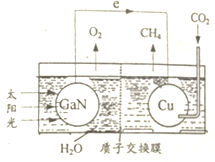 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是| A. | 该装置中存在两种能量的转换形式 | |
| B. | 电池工作时,H+向负极移动 | |
| C. | 为提高该人工光合系统的工作效率,最好向装置中加入少量盐酸 | |
| D. | 铜电极表面的电极反应式为:C02+8e-+8H+═CH4+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
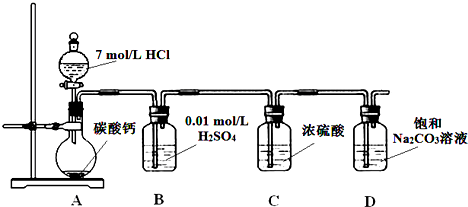
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: ;反应类型:取代反应
;反应类型:取代反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com