
| A. | 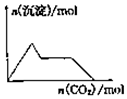 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 | |
| B. | 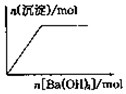 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 | |
| C. | 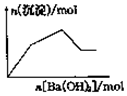 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 | |
| D. | 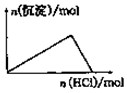 向NaAlO2溶液中逐滴加入盐酸至过量 |
分析 A、向一定量的氢氧化钙和氢氧化钾溶液中通入二氧化碳,开始先和氢氧化钙反应,会生成碳酸钙,当氢氧化钙完全反应后,再和氢氧化钾反应,最后将碳酸钙溶解;
B、NaHSO4溶液中逐滴加入Ba(OH)2溶液会产生越来越多的硫酸钡白色沉淀;
C、KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液开始铝离子和硫酸根逐渐形成沉淀,然后形成的氢氧化铝逐渐溶解,直到只剩余硫酸钡为止,结合具体数据分析反应过程;
D、NaAlO2溶液中逐滴加入盐酸,开始出现沉淀,然后沉淀逐渐溶解.
解答 解:A、向一定量的氢氧化钙和氢氧化钾溶液中通入二氧化碳,开始先和氢氧化钙反应,会逐渐生成碳酸钙沉淀,沉淀量逐渐增大,当氢氧化钙完全反应后,再和氢氧化钾反应,此时沉淀量不变,当氢氧化钾消耗完毕时,将碳酸钙逐渐溶解,沉淀量逐渐减少,故A错误;
B、NaHSO4溶液中逐滴加入Ba(OH)2溶液会产生越来越多的硫酸钡白色沉淀,直到最大量,然后不再减少为止,故B正确;
C、假设含2molKAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,开始阶段滴加入3molBa(OH)2时,2mol铝离子和3mol硫酸根分别和氢氧根和钡离子反应生成2mol氢氧化铝和3mol硫酸钡沉淀共5mol沉淀,然后再滴加入1molBa(OH)2时,继续形成1mol的硫酸钡沉淀但同时有会溶解2mol氢氧化铝沉淀,所以这一段沉淀的物质的量并没有增多反而减小,再滴加入Ba(OH)2时无反应发生最终只剩余硫酸钡沉淀,故C错误;
D、NaAlO2溶液中逐滴加入盐酸,开始出现沉淀,然后过量的盐酸又将沉淀逐渐溶解掉,应该是1份沉淀,3份溶解,故D错误.
故选B.
点评 本题考查元素化合物的知识,重点为物质间的相互反应,难点要考虑反应的先后顺序问题,属于偏难题.


科目:高中化学 来源: 题型:实验题
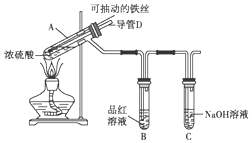
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  CH3+Cl2$\stackrel{光照}{→}$ CH3+Cl2$\stackrel{光照}{→}$ CH2Cl+HCl CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$ 2CH3CHO+2H2O | |
| C. | ClCH2═CH2+NaOH$→_{△}^{水}$ HOCH2CH═CH2+NaCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

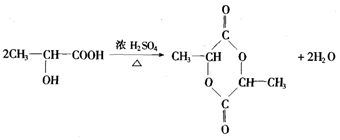
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 在常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 17 g氨气所含原子数目为4 NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是( )
A.1×10-7mol·L-1 B.1×10-12mol·L-1
C.1×10-2mol·L-1 D.1×10-14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/MPa | 10 | 20 | 30 | 40 |
| φ(NH3) | 0.30 | 0.45 | 0.54 | 0.60 |
| A. | 10 MPa时,H2的转化率为75% | |
| B. | 20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍 | |
| C. | 40 MPa时,若容器的体积为VL,则平衡常数$K=\frac{{64{V^2}}}{3}$ | |
| D. | 30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com