
【题目】图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断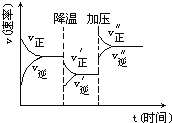
A. A、B、C、D均为气体
B. 若A、B是气体,则C、D是液体或固体
C. 温度越高,K越大
D. 在整个过程中,A的转化率一直增大
【答案】D
【解析】
由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,以此可解答该题。
A.若A、B、C、D均为气体,增大压强平衡向逆反应方向移动,图示增大压强平衡向正反应方向移动,故A错误;
B.图示增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,若A、B是气体,D是液体或固体,增大压强平衡向正反应方向移动与图示一致,若C、D是液体或固体,加压逆反应速率不变,故B错误;
C.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则温度越高,K越小,故C错误;
D.图象中改变条件降低温度、增大压强时平衡都是正向进行,A的转化率一直增大,故D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
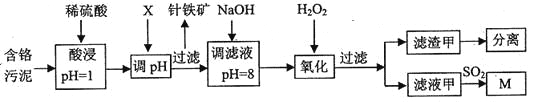
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 6.7 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 9.3 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________(任写一条)。
(2)调节pH所用X可以选用______。
A.NaOH B.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为________。
(4)调滤液至pH=8,则滤液中______将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=______。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。

请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),通入CH3OH一极的电极反应式为_____________________________________________________________;
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”、“阴极”或“阳极”),总反应式为_________________________________________________________;
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________ mL(标准状况),丙池中________极析出________ g铜;
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”);丙中溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如图:

已知:RNH2+ +H2O
+H2O
回答下列问题:
(1)A中官能团的名称是___,F的化学名称是__。
(2)G的结构简式为___。
(3)由C生成E,E和H生成J的反应类型分别是__、___。
(4)C和D生成E的化学方程式为___。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有___种,其中核磁共振氢谱有四组峰的结构简式为__(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在![]() 之间,通过电解生成
之间,通过电解生成![]() 沉淀.
沉淀.![]() 有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去
有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去![]() 或撇掉
或撇掉![]() 浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:

![]() 电解池阳极的电极反应分别是:
电解池阳极的电极反应分别是:![]() ______ ;
______ ;![]()
![]() 熔融盐燃料电池是以熔融碳酸盐为电解质,以
熔融盐燃料电池是以熔融碳酸盐为电解质,以![]() 为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:
为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:![]()
![]() 正极的电极反应是 ______ .
正极的电极反应是 ______ .
![]() 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是 ______ .
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是 ______ .
![]() 实验过程中,若在阴极产生了
实验过程中,若在阴极产生了![]() 标准状况
标准状况![]() 气体,则熔融盐燃料电池消耗
气体,则熔融盐燃料电池消耗![]() 标准状况
标准状况![]() ______ L.
______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是利用一种微生物将废水中尿素![]() 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。回答下列问题:
的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。回答下列问题:
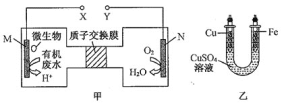
![]() 铜电极应该与 ______电极相连,Fe电极的电极反应式__________
铜电极应该与 ______电极相连,Fe电极的电极反应式__________
![]() 甲中
甲中![]() 通过质子交换膜向_____极移动,M电极的电极方程式_______
通过质子交换膜向_____极移动,M电极的电极方程式_______
![]() 当铜电极减重___g,Fe电极增重16g,N极消耗气体的体积
当铜电极减重___g,Fe电极增重16g,N极消耗气体的体积![]() 标准状况下
标准状况下![]() 为____L。
为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 常温下,用pH 计分测 | pH | 酸性: |
B | 向 | 溶液褪色 | 乙二酸具有还原性 |
C |
| 先有白色沉淀,后沉淀消失 |
|
D | 取2mL | 先有白色沉淀生成;后有红褐色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A. 氢氧燃料电池工作时,![]() 在负极上失去电子
在负极上失去电子
B. ![]() 溶液加热后,溶液的pH减小
溶液加热后,溶液的pH减小
C. 常温常压下,![]() 中含有的分子数为
中含有的分子数为![]() 个
个
D. 室温下,稀释![]() 溶液,溶液的导电能力增强
溶液,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废铝屑(含Al、Al2O3、Fe及Fe的氧化物)制取纯净的无水氯化铝,主要过程如下:
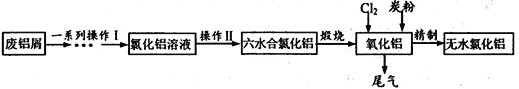
(1)检验氯化铝溶液中是否含有微量的Fe3+,可用的试剂为__________。
(2)操作II的步骤为__________、结晶、过滤、洗涤。
(3)煅烧过程的化学反应方程式为____________________。
(4)在强热条件下,Al2O3转化为AlCl3的反应如下:
Al2O3(s)+3Cl2(g)+3C(s)=2AlCl3(g)+3CO(g) △H>0
Al2O3(s)+3Cl2(g)+ ![]() C(s)=2AlCl3(g)+
C(s)=2AlCl3(g)+ ![]() CO2 (g) △H<0
CO2 (g) △H<0
工业上在通氯气的同时鼓入适量的氧气,其目的是:
①除去多余的碳粉;②_________。
(5)利用下列试剂设计由废铝制备氧化铝溶液的“一系列操作I”的实验方案:________。
实验中可供选择的试剂:6mol·L-1HCl溶液、3 mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、氨水、H2O、CO2。
(6)AlCl3的熔点为190℃,沸点为183℃。1973年美国Alcoa公司研究出一种新的氯化铝电解制铝法。将AlCl3和NaCl、KCl、LiCl混溶电解冶炼铝,其中NaCl、KCl、LiC的作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com