
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO33H2O.实验过程如图1: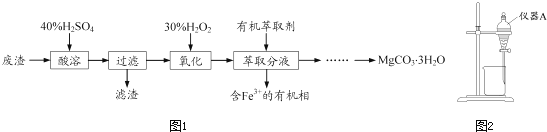
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(S)+2H+(aq)═Mg2+(aq)+CO2(g)+H2O(l)△H=﹣50.4kJmol﹣1
Mg2SiO4(s)+4H+(aq)═2Mg2+(aq)+H2SiO3(s)+H2O(l)△H=﹣225.4kJmol﹣1
酸溶需加热的目的是;所加H2SO4不宜过量太多的原因是 .
(2)加入H2O2氧化时发生发应的离子方程式为 .
(3)用图2所示的实验装置进行萃取分液,以除去溶液中的Fe3+ .
①实验装置图中仪器A的名称为 .
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,、静置、分液,并重复多次.
(4)请补充完整由萃取后得到的水溶液制备MgCO33H2O的实验方案:边搅拌边向溶液中滴加氨水, , 过滤、用水洗涤固体2﹣3次,在50℃下干燥,得到MgCO33H2O.
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全].
【答案】
(1)加快酸溶速率;避免制备MgCO3时消耗过多的碱
(2)2Fe2++2H++H2O2=2Fe3++2H2O
(3)分液漏斗;充分振荡
(4)至5<pH<8.5,过滤,边搅拌边向滤液中滴加碳酸钠溶液至有大量沉淀生成,静置,向上层清夜中滴加碳酸钠溶液,若无沉淀生成
【解析】废渣主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物,加入40%的硫酸酸溶,过量后滤液中含有硫酸镁、硫酸亚铁以及硫酸铝,加入H2O2氧化亚铁离子,然后加入有机萃取剂萃取Fe3+ , 分液后可除去溶液中的Fe3+ , 分液后水溶液中含有Mg2+、Al3+ , 可调节溶液pH至5<pH<8.5,可除去Al3+ , 又可防止生成Mg(OH)2 , 过滤后在滤液中加入碳酸钠溶液,可生成MgCO3沉淀,在50℃下干燥,得到MgCO33H2O.
(1)加热,温度升高,可增大反应速率,即加快酸溶速率,但加入硫酸不能过多,避免制备MgCO3时消耗过多的碱而浪费原料,
所以答案是:加快酸溶速率;避免制备MgCO3时消耗过多的碱;
(2)加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,所以答案是:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)①由装置图可知仪器A为分液漏斗,用于萃取、分液,所以答案是:分液漏斗;②萃取时,为使溶质尽可能被萃取,应充分振荡,以充分接触而分离,所以答案是:充分振荡;
(4)分液后水溶液中含有Mg2+、Al3+ , 可调节溶液pH至5<pH<8.5,可除去Al3+ , 又可防止生成Mg(OH)2 , 过滤后在滤液中加入碳酸钠溶液,可生成MgCO3沉淀,静置,向上层清夜中滴加碳酸钠溶液,若无沉淀生成,说明已完全反应,过滤后,用水洗涤固体2﹣3次,在50℃下干燥,得到MgCO33H2O.
所以答案是:至5<pH<8.5,过滤,边搅拌边向滤液中滴加碳酸钠溶液至有大量沉淀生成,静置,向上层清夜中滴加碳酸钠溶液,若无沉淀生成.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】标准状态下,在四个干躁的烧瓶中分别充入:①纯净的氨气,②混有 ![]() 体积空气的氯化氢气体,③纯净的NO2气体,④混有少量O2的NO2气体.然后各做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
体积空气的氯化氢气体,③纯净的NO2气体,④混有少量O2的NO2气体.然后各做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
A.①=②=③=④
B.①=②=③>④
C.①=②=③<④
D.④>①=②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关三氧化硫的说法中正确的是( )
A. SO3极易溶于水,且与水反应生成H2SO4
B. SO2、SO3均具有漂白性,均能使石蕊溶液变红色
C. SO3可与碱反应,但不与碱性氧化物反应
D. SO2在空气中易被氧化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应所画图象错误的是( )
A | B | C | D |
将二氧化硫通入 | 将氨水滴入到一定 | 将铜粉加入到 | 将铁粉加入到一 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下面的实验一和实验二,探究某些化学理论.
(1)实验一:以反应2Fe3++2I﹣=2Fe2++I2为例, 探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mLFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示: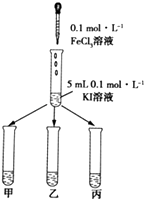
若试管甲中出现现象;
乙试管中出现现象,
则说明该反应为可逆反应.
(2)实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
序号 | 反应温度/℃ | C(HCl)/molL﹣1 | V(HCl)/mL | 10g碳酸钙的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t 1 |
② | 20 | 4 | 10 | 块状 | t 2 |
③ | 20 | 2 | 10 | 粉末 | t 3 |
④ | 40 | 2 | 10 | 粉末 | t 4 |
⑤ | 40 | 4 | 10 | 粉末 | t5 |
※t表示收集相同状况下体积都为a mL CO2所需的时间※
(i)由表格中的信息可知实验二的目的是探究
(ii)实验①和实验②是探究对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有
(iii)收集a mL CO2所需的时间最少的实验是(填实验序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的相应结论正确的是( )
实验事实 | 结论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
C | 将Na2CO3溶液与苯酚悬浊液混合溶液变澄清 | 酸性:苯酚>HCO3- |
D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去). 
(1)若A为强碱溶液,其焰色反应显黄色,C常用作食品添加剂,请回答下列问题:
①物质的量浓度相同的B、C水溶液的pH前者(填大于或小于)后者.
②反应Ⅲ的离子方程式是 .
③现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,则B的质量分数为 .
(2)若C、D均为金属单质,向A溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则:①反应 III的离子方程式是 .
②实验室中储存B溶液时应加入 .
③检验溶液A中金属阳离子的方法是 .
(3)若D为强电解质、B为难溶于水的沉淀,
①则A和C反应的离子方程式
②符合条件的D物质可能是下列物质中的(填序号).
a.硫酸 b.醋酸 c.氢氧化钠 d.氨水 e.氯化钡 f.硝酸镁.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+Br2=2FeBr3 , 现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl﹣和Br﹣ 的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A.2molL﹣1
B.1molL﹣1
C.0.4molL﹣1
D.0.2molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com