
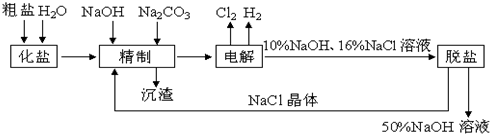
分析 (1)电解氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极附近生成氢氧化钠;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,杂质离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子;
(3)工业食盐中如果含有SO42-,则可加Ba2+形成BaSO4白色沉淀;由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2;
(4)粗盐中含大量Ca2+、Mg2+、SO42-,为有效除去这些离子,选NaOH除去镁离子,碳酸钠除去钙离子、氯化钡除去硫酸根离子,但碳酸钠一定在氯化钡之后,可除去过量的钡离子;
(5)经过一段时间的电解,NaCl溶液浓度在下降,NaOH溶液浓度在上升.当NaOH溶液质量分数变成10%,NaCl溶液质量分数变成16%时,停止电解,电解液加热蒸发,由于NaOH的溶解度大于NaCl,通过蒸发浓缩、冷却、结晶和过滤后可除去后经过滤除去NaCl,获得的NaCl可循环使用,据此进行解答.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,杂质离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以Ca2+、Mg2+除杂过程中涉及的离子方程式为:Ca2++CO32-═CaCO3↓;Mg2++2OH-═Mg(OH)2↓,故答案为:Ca2++CO32-═CaCO3↓;Mg2++2OH-═Mg(OH)2↓;
(3)除去粗盐中的SO42-,可加Ba2+形成BaSO4白色沉淀,由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2,故ac正确,
故答案为:ac;
(4)粗盐中含大量Ca2+、Mg2+、SO42-,为有效除去这些离子,选NaOH除去镁离子,碳酸钠除去钙离子、氯化钡除去硫酸根离子,但碳酸钠一定在氯化钡之后,可除去过量的钡离子,bc均符合,故答案为:bc;
(5)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发浓缩、冷却、结晶、过滤;
故答案为:加热蒸发;过滤.
点评 本题考查混合物分离提纯的综合应用及海水资源利用等,为高频考点,把握分离流程中的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质R的转化率减少了 | ||
| C. | 物质X的质量分数减少了 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应会放出热量 | |
| B. | 每生成1mol N2,转化电子数为4mol | |
| C. | 等物质的量N2和CO质量相同 | |
| D. | 该反应不需要催化剂常温下也能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| B. | C的平衡浓度为1mol/L | |
| C. | 5min内B的平均消耗速率为0.3mol/(L•min) | |
| D. | 平衡后,增大压强,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol,碳的燃烧热为110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石不如石墨稳定 | |
| C. | 金刚石和石墨的转化是物理变化 | |
| D. | C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH- | ||
| C. | KClO3=K++ClO3- | D. | MgSO4═Mg+2+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为4mol | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为1:5 | |
| C. | 3mol Fe2+被氧化时,消耗O2标准状况下的体积约为22.4L | |
| D. | x=4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com