
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼������ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������___min����0��1��1��2��2��3��3��4��4��5������Ӧ��ʼ��Ӧ�����������ԭ����__��
����3��4����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����__________������Һ������䣩��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���_��
A������ˮ B��KCl��Һ C��KNO3��Һ D��CuSO4��Һ
(3)ij�¶�����4L�ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��仯������ͼ
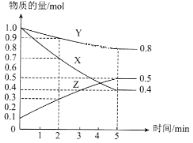
�ٸ÷�Ӧ�Ļ�ѧ����ʽ��__________��
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��__________��
A��X��Y��Z�ķ�Ӧ������� B�������������ܶȱ��ֲ��� C������������ѹǿ���ֲ��� D������3molX��ͬʱ����1mol Y
��2min��X��ת����Ϊ__________��
���𰸡�2~3 ��Ϊ��Ӧ��ʼ���¶ȶԷ�Ӧ������������Ե����ã���Ӧ�Ƿ��ȷ�Ӧ,�����¶ȷ�Ӧ�������� 0.025mol/(L��min) CD 3X+Y2Z CD 30%
��������
(1)����ͬͨ�����£���Ӧ����Խ����ͬʱ�����ռ�������Խ�ࣻ�ɱ������ݿ�֪����Ӧ��������ʱ�����2��3 min����Ϊ��Ӧ��ʼ���¶ȶԷ�Ӧ������������Ե����ã���Ӧ�Ƿ��ȷ�Ӧ�������¶ȷ�Ӧ��������
��3��4����ʱ��Σ��ռ����������=(576-464)mL=112mL��n(H2)=![]() =0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=
=0.005mol������������HCl��ϵʽ�����ĵ�n(HCl)=2n(H2)=2��0.005mol=0.01mol����v(HCl)=![]() =0.025 mol/(Lmin)��
=0.025 mol/(Lmin)��
(2)A����������ˮ��������Ũ�ȼ�С����Ӧ���ʽ��ͣ���A��ѡ��
B������KCl��Һ��������Ũ�Ƚ��ͣ���Ӧ���ʽ��ͣ���B��ѡ��
C������KNO3��Һ���൱�ں������ᣬ�����Zn��Ӧ����NO��������������Cѡ��
D������CuSO4��Һ��Zn��ͭ���ӷ�Ӧ����Cu��Zn��Cu��ϡ���ṹ��ԭ��ض��ӿ췴Ӧ���ʣ���Dѡ��
(3)�ٸ���ͼ֪�����ŷ�Ӧ���У�X��Y�����ʵ������ٶ�Z�����ʵ������ӣ���X��Y�Ƿ�Ӧ���Z���������Ӧ�ﵽƽ��ʱ����n(X)=(1.0-0.4)mol=0.6mol����n(Y)=(1.0-0.8)mol=0.2mol����n(Z)=(0.5-0.1)mol=0.4mol��ͬһ���淴Ӧ��ͬһ��ʱ���ڲμӷ�Ӧ�ĸ����ʵ����ʵ����仯��֮�ȵ��������֮�ȣ�X��Y��Z�ļ�����֮��=0.6mol��0.2mol��0.4mol=3��1��2����÷�Ӧ����ʽΪ3X+Y2Z��
��A������֮�ȵ��ڼ�����֮�ȣ�X��Y��Z���߷�Ӧ���ʲ�������ȣ���A����
B����Ӧ����������Ϊ���壬���Է�Ӧ��������������������䣬�����ݻ��㶨������������ܶ�ʼ�ղ��䣬��B����
C���÷�Ӧǰ������ϵ��֮�Ͳ���ȣ�����δƽ��ʱ����������ʵ�����䣬�����ݻ��㶨������ѹǿ��䣬������������ѹǿ���ֲ���ʱ����Ӧ�ﵽƽ��״̬����C��ȷ��
D������3molX��ͬʱ������1molY��ͬʱ������1mol Y�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
��ѡ��CD��
��2min��Xת��1.0mol-0.7mol=0.3mol����X��ת����Ϊ![]() ��100%=30%��
��100%=30%��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs����������![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
A.Ts�ǵ������ڵڢ�A��Ԫ��
B.Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C.Ts��ͬ��Ԫ���зǽ���������
D.������Ϊ176��Ts���ط�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ӦΪ��N2(g)+3H2(g)![]() 2NH3(g)��ͼ1��ʾ��һ�����¶��´˷�Ӧ�����е������ı仯��ͼ2��ʾ��2L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߣ�ͼ3��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�죮����˵����ȷ����
2NH3(g)��ͼ1��ʾ��һ�����¶��´˷�Ӧ�����е������ı仯��ͼ2��ʾ��2L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߣ�ͼ3��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�죮����˵����ȷ����
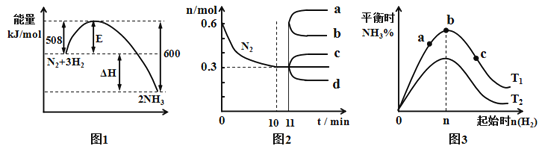
A����ͼ1��֪2NH3(g)![]() N2(g)+3H2(g) ��H=��92kJ��mol��1
N2(g)+3H2(g) ��H=��92kJ��mol��1
B��ͼ2��0��10min�ڸ÷�Ӧ��ƽ������v(H2)=0.09mol��L��1��min��1
C��ͼ2�д�11min�������������䣬ѹ���������������n(N2)�ı仯����Ϊd
D��ͼ3���¶�T1��T2��a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)��һ�ְ�ɫ�綾���壬��������ȫ���ҵ���Ҫ�ɷ֡�NaN3������ˮ�������Ҵ���ˮ��Һ�������ԣ������ᷢ����Ӧ�������б�ը�Ե��ж�����������⡣ʵ���ҿ������������嶡��(t��BuNO2����t��Bu��ʾ�嶡��)��N2H4������������Һ��Ϸ�Ӧ�Ʊ��������ơ�
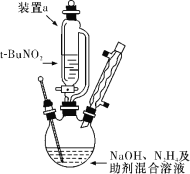
��1������ͼ��ʾ��װ����(����װ����)���з�Ӧ����Ӧ����ʽΪ��t��BuNO2��NaOH��N2H4=NaN3��2H2O��t��BuOH
��װ��a�IJ�ܵ�������________________��
�ڸ÷�Ӧ������¶���65 �������õ�ʵ���ʩ��_______________��
�۷�Ӧ����Һ��0 ������ȴ���д���������������ˣ����þ���ʹ����ˮ�Ҵ�ϴ�ӡ��Խ��͵����¹��˺�ʹ����ˮ�Ҵ�ϴ�Ӿ����ԭ����_________��
��2�����ʼ���
�ٳ�ȡ2.0 g�����������������100 mL��Һ������ȡ10.00 mL��Һ����ƿ�С�
���õζ��ܼ���0.10 mol��L��1���������[(NH4)2Ce(NO3)6]��Һ40.00 mL�����ķ�ӦΪ[2(NH4)2Ce(NO3)6��2NaN3=4NH4NO3��2Ce(NO3)3��2NaNO3��3N2��](�������ʾ������뷴Ӧ)��
��3����ַ�Ӧ����Һϡ�Ͳ��ữ������2���ڷ�����ָʾҺ������0.10 mol��L��1���������[(NH4)2Fe(SO4)2]Ϊ��Һ���ζ�������Ce4�����յ�ʱ���ı���Һ20.00 mL(�ζ�ԭ����Ce4����Fe2��=Ce3����Fe3��)�������֪�������Ƶ���������Ϊ_______(����2λ��Ч����)��
��4�����������ж�������ʹ�ô���������Һ�Ժ��е������Ƶ���Һ�������٣���Ӧ����Һ����������ǿ���Ҳ�����ɫ��ζ�������壬��д����Ӧ�����ӷ���ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | �ȽϽ���þ�����Ļ����� | �քe����ֻʢ�е������Ũ�ȵ�ϡ�����ձ��м����ĥ����ͬ����С��þƬ����Ƭ���ȽϷ�Ӧ���� |
B | ��ȥMg���л��е�Al �� | ����������NaOH ��Һ�����ˡ�ϴ�ӡ����� |
C | ̽��ά����C�Ļ�ԭ�� | ��ʢ��2 mL��ɫ�Ȼ�����Һ���Թ��еμ�Ũ��ά����C��Һ���۲���ɫ�仯 |
D | ����0.4000mol��L1��NaOH��Һ | ��ȡ4.0g����NaOH���ձ��У�ֱ�����ձ��м���250mLˮ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�кܶ���Ҫ�Ļ���ԭ�϶���Դ��ʯ�ͻ�������ͼ�еı�����ϩ���л���A�ȣ�����A�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����ش��������⣺
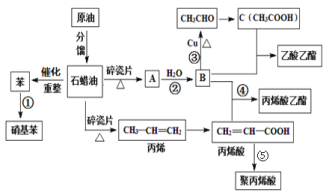
(1)A�Ľṹ��ʽΪ________________����ϩ���й����ŵ�����Ϊ___________________��
(2)д�����з�Ӧ�ķ�Ӧ���͢�___________________����________________________��
(3)����˵����ȷ����_____________��
A���������л���ŨHNO3��H2SO4�����䵹�뵽NaOH��Һ�У������ã���Һ
B����ȥ���������е����ᣬ��NaOH��Һ����Һ
C���۱�ϩ���ܹ�ʹ���Ը��������Һ��ɫ
D���л���C���ϩ������ͬϵ��
(4)д�����з�Ӧ����ʽ��
��B��CH3CHO_________________________________________��
�ܱ�ϩ�� + B����ϩ������_____________________��
�ݱ�ϩ�����۱�ϩ��_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҫ����գ�
(1)��0.10mol/L NH3H2O��Һϡ��10������ϡ�ͺ����Һ��c(OH��)____ԭ����ʮ��֮һ(��������������С��������������)��
(2)ʵ����0.10mol/L CH3COONH4��Һ��pH=7����c(CH3COO-)_____c(NH4+)(��дͬ��)��
(3)���÷�Ӧ��I2+2Na2S2O3=Na2S4O6+2NaI���Զ����ⶨ�������������(M=158)�Ĵ��ȣ����ڳ�ȡ7.900g��������ƹ�����Ʒ�����250mL����Һ��ȡ25.00mL������ƿ�У�����ָʾ�����ú���I2Ϊ 0.1000mol/L�ĵ�ˮ�ζ������ĵ�ˮ20.00mL����
�ٵζ�Ӧѡ���ָʾ����____________���ζ��յ��������:____________________________
�ڶ��ڸõζ�ʵ����йز�������������ȷ������_______��
A���ζ�ǰ��Ӧ�Եζ��ܡ���ƿ������ϴ����
B���ζ������У���Һ�ε���ƿ�⣬��ʹ������ƫ��
C���ζ����ڵζ���ʼʱ���������ݣ��ζ���ɺ�������ʧ��������õĴ��Ƚ���ƫС
D���ζ�ǰ���Ӷ������ζ�����ʱƽ�Ӷ�����������õĴ��Ƚ���ƫС
����Ʒ����������ƴ���Ϊ______________________________
(4)CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ������ǰNa2CO3��Һ��Ũ��Ϊ2��10-4mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ______ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ�أ�����ԭ�ӵĺ˵������С��18�������ε�����Aԭ�Ӻ��ڽ���һ�����ӣ�Bԭ�ӵĵ���������Dԭ�ӵ�������������ȣ�Aԭ����Bԭ�ӵ�����������֮����Cԭ�ӵ�������������ȣ�Dԭ�����������Ӳ㣬�����������Ǵ�����������3����
��1�����ƶ�д�����ǵ�Ԫ�ط��ţ�A______��B______��C______��D______��
��2������D�����ӽṹʾ��ͼ___________________��
��3����������Ԫ����ɵ�����10���ӵķ���ʽ��_________ ��д���÷��ӵĵ���ʽ _________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ������Ҫ����Ӯ���챣��ս������ζ�ŶԴ�����Ⱦ���αȹ�ȥҪ����ߡ���������-�������ӽ���Ĥȼ�ϵ��ʵ���������ᡢ���硢������λһ��Ľ�ϣ�ԭ����ͼ��ʾ������˵����ȷ����
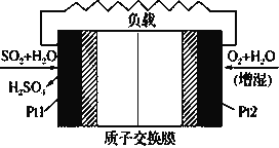
A.�õ�طŵ�ʱH+��Pt2�缫�����ڵ�·����Pt1�缫
B.Pt1�缫���������ķ�Ӧ��SO2��2H2O��2e��=H2SO4��2H��
C.Pt2�缫���������ķ�ӦΪ: O2��2H2O��4e��=4OH��
D.�ŵ�����������ĵ�22.4L O2����״������Pt1�缫������4mol H��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com