
| A. | 装有干海带的坩埚置于泥三角上加热灼烧 | |
| B. | 加入过量的氯水确保I-被完全氧化 | |
| C. | 用四氯化碳溶液萃取碘单质,上层为水层可以弃去 | |
| D. | 可利用碘单质易升华的特性来提纯碘单质 |
科目:高中化学 来源: 题型:选择题
| 实验装置 | 部分实验现象 | 实验装置 | 部分实验现象 |
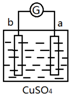 | a极质量减小, b极质量增加 | 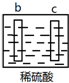 | b极有气体产生, c极无变化 |
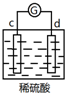 | d极溶解, c极有气体产生 | 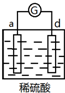 | 电流计指示在导线中电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H和3H是不同的核素 | |
| B. | 1H、2H、3H、H+和H2是氢元素的五种不同粒子 | |
| C. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 | |
| D. | 石墨和金刚石互为同位素,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的盐在水溶液中都能水解 | |
| B. | 盐类水解一定都显酸性或碱性 | |
| C. | 盐类的水解反应是酸碱中和反应的逆反应,因此盐类水解是吸热反应 | |
| D. | 盐类水解抑制了水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com