
【题目】向含SO![]() 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是 ( )
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是 ( )
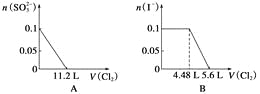

【答案】C
【解析】离子还原性SO32->I->Fe2+>Br-,故首先发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积。
A、由SO32-+Cl2+H2O=SO42-+2Cl-+2H+可知,0.1molSO32-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故A错误;
B、0.1molSO32-完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1molSO32-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molI-完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,故B错误;
C、0.1molSO32-完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际符合,故C正确;
D.SO32-、I-、Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=2Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故溴离子完全反应时消耗氯气的体积为4.48L+0.05mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故D错误;


科目:高中化学 来源: 题型:
【题目】下列现象是因为发生取代反应的是( )
A. 乙烯使酸性KMnO4溶液褪色 B. 乙烯使溴水褪色
C. 点燃乙烯出现黑烟 D. 甲烷与氯气的混合气体,光照一段时间后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以2 molL-1的Na2SO4溶液为电解质溶液的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4![]() Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
A. 放电时,NaTi2(PO4)3发生氧化反应
B. 放电时,Na+向锌棒一极移动
C. 充电时,阳极反应式为[Ti2(PO4)3]--2e-=[Ti2(PO4)3]3-
D. 充电时,每转移0. 2 mol电子,阴极增重6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X,Y,Z三种元素,其中Y,Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol.在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色.试回答:
(1)元素符号:X , Y , Z .
(2)Y的两种氧化物为和 . 写出此两种氧化物与水反应的化学方程式; .
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为 .
(4)写出Y和Z形成的化合物的电子式:;Z单质分子的电子式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向下列各物质的水溶液中滴加稀H2SO4或MgCl2溶液时,均有白色沉淀生成的是
A.BaCl2 B.Na2CO3 C.KOH D.Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂,无水氯化钴呈蓝色,吸水后变为CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成分是氢氧化钠、氧化钙,制法是:把生石灰加到浓的烧碱溶液中,再加强热蒸干)。上述物质中,属于混合物的是( )
A.①②④B.②④C.①③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
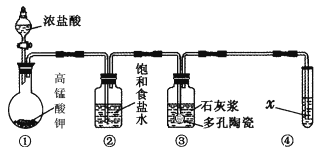
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前几年我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2 , X原子的结构示意图为 ![]() ,X的阳离子与Y的阴离子的电子层结构相同.元素Z,W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z,W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z,W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z,W能形成一种WZ2型分子.
(1)m= , 该融雪剂的化学式为 . 用电子式表示该融雪剂微粒的形成过程: .
(2)Z,W元素的名称为、 .
(3)下列说法正确的是 .
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是 .
A.XY2的电子式:X2+[ ![]()
![]()
![]()
![]()
![]() ]2﹣
]2﹣
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2﹣═2Y+Z↓
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温.抗冲击.导热性好等优良性质,被广泛应用于电子工业.陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C ![]() 2AlN+3CO下列叙述正确的是( )
2AlN+3CO下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.氮化铝是铝合金中的一种
C.上述反应中每生成2molAlN,N失去6mol电子
D.氮化铝中氮元素的化合价为﹣3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com