
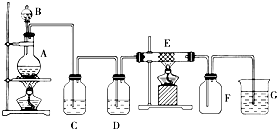
 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
| ||
| ||
| ||
| ||


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
| A、氯化钡溶液和碳酸钠溶液 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、偏铝酸钠溶液和稀硫酸 |
| D、碳酸钠溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氢氧化钾溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| B、在亚硫酸中加入过量的次氯酸钠溶液 H2SO3+3ClO-=Cl-+2HClO+SO42- |
| C、在稀HNO3溶液加入FeS固体 FeS+2H+=Fe2++H2S↑ |
| D、在过氧化钠中加入稀硫酸 2Na2O2+4H+=4Na++2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度 (mol?L-1) | 0.00l0 | 0.0100 | 0.0200 | 0.1000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
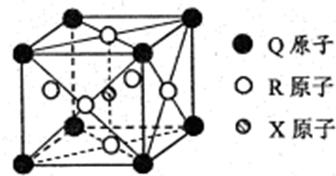
 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定前 | 第一次 终点 | 第二次 终点 | 第三次 终点 | |
| 碱式滴定管 液面刻度 | 0.10mL | 19.12mL | 18.15mL | 19.08mL |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com