
| ���ʵ�� | Ԥ��Ŀ�� | |
| A | ��ͬ�¶��£����������Ĵ���ʯ�顢����ʯ��ĩ�ֱ������������Ũ�ȵ�����ʹ����У��۲����ݲ����Ŀ��� | ��֤����Ӵ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� |
| B | ���淴ӦFeCl3��aq��+3KSCN��aq��?Fe��SCN��3��aq��+3KCl��aq�� ����ƽ�����������������ʱ������KCl���壬�۲���ϵ��ɫ�ı仯 | ��֤Ũ�ȶԻ�ѧƽ���Ӱ�� |
| C | ��MgCl2��Һ�������� | ��MgCl2��Һ�Ʊ���ˮMgCl2 |
| D | ��ͬ�¶��£���֧�Թ���װ�е��������Ũ�ȵ�H2O2��Һ�������зֱ��������FeCl3�����������MnO2���� | ��֤��ͬ������H2O2�ֽ����ʵ�Ӱ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��Ҫ��֤����Ӵ�����Ի�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ��ֻ�й���Ӵ������ͬ������������ȫ��ͬ��
B���÷�Ӧ��ʵ����KCl���μӷ�Ӧ��KClŨ�ȴ�С�Ը÷�Ӧ������Ӱ�죻
C���Ȼ�þ��ǿ�������Σ�þ����ˮ������������þ��HCl�������¶ȴٽ�����ӷ����Ӷ��ٽ��Ȼ�þˮ�⣻
D����ʵ����ֻ�д�����ͬ������������ȫ��ͬ��
��� �⣺A����ʵ�����ͬ������Ӵ������ͬ������Ӱ�췴Ӧ���ʵ�����������������ʵ��ʵ��Ŀ�ģ���A����
B���÷�Ӧ��ʵ����KCl���μӷ�Ӧ��KClŨ�ȴ�С�Ը÷�Ӧ������Ӱ�죬��ͨ���ı�KClŨ�Ȳ���Ӱ��ƽ���ƶ�����B����
C���Ȼ�þ��ǿ�������Σ�þ����ˮ������������þ��HCl�������¶ȴٽ�����ӷ����Ӷ��ٽ��Ȼ�þˮ�⣬Ӧ����HCl��Χ�м����Ȼ�þ��Һ����C����
D����ʵ����ֻ�д�����ͬ������������ȫ��ͬ�����Կ���ʵ��ʵ��Ŀ�ģ���D��ȷ��
��ѡD��
���� ���⿼�黯ѧʵ�鷽�����ۣ�Ϊ��Ƶ���㣬�漰��ѧ��Ӧ����Ӱ�������жϡ�����ˮ�⡢ƽ���ƶ�ԭ����֪ʶ�㣬��ȷʵ��ԭ�������������ǽⱾ��ؼ����״�ѡ����B��ֻ��ʵ���ϲμӷ�Ӧ�����ʻ����ӵ�Ũ�Ȳ���Ӱ��ƽ���ƶ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��С | ||
| C�� | ����������С | D�� | ����С������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2 | B�� | CH3CH3 | C�� | NaCl | D�� | N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ͨ���廯������Һ�У�3Cl2+2Fe2++4Br-�T6Cl-+2Fe3++2Br2 | |
| B�� | ͭƬ��ϡ���ᷴӦ��Cu+NO3-+4H+=Cu2++NO��+2H2O | |
| C�� | Fe2��SO4��3��������Һ��ͨ����������Fe3++H2S=Fe2++S��+2H+ | |
| D�� | ��̼�������Һ�м����������������ҺCa2++HCO3-+OH-=CaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
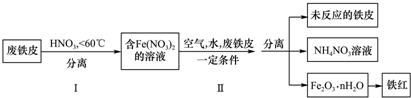
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | D2+��A2+��B2+��C2+ | B�� | C2+��B2+��A2+��D2+ | C�� | D2+��C2+��A2+��B2+ | D�� | A2+��B2+��D2+��C2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ag2S | B�� | HgS | C�� | HgCl2 | D�� | AgCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com