
分析 pH为3的某酸溶液分为强酸溶液和弱酸溶液两种情况分析,pH=3的弱酸与pH=11氨水等体积混合,所得溶液的酸性性取决于电离程度的相对大小.
解答 解:pH为3的某酸溶液分为强酸溶液和弱酸溶液两种情况,
①当为强酸溶液时
pH=3的强酸与pH=11氢氧化钠溶液等体积混合,恰好完全反应生成强酸强碱盐,溶液呈中性;
pH=3的强酸与pH=11氨水等体积混合,氨水有剩余,一般溶液呈碱性;
②当为弱酸溶液时
pH=3的弱酸与pH=11氢氧化钠溶液等体积混合,弱酸有剩余,一般溶液呈酸性;
pH=3的弱酸与pH=11氨水等体积混合,所得溶液的酸性性取决于电离程度的相对大小,
若弱酸的电离程度大于氨水,则等体积混合后,氨水剩余,所得溶液一般呈碱性;
若弱酸的电离程度等于氨水,则等体积混合后,所得溶液呈中性;
若弱酸的电离程度小于氨水,则等体积混合后,弱酸剩余,所得溶液一般呈酸性;
答:①当为强酸溶液时
pH=3的强酸与pH=11氢氧化钠溶液等体积混合,恰好完全反应生成强酸强碱盐,溶液呈中性;
pH=3的强酸与pH=11氨水等体积混合,氨水有剩余,一般溶液呈碱性;
②当为弱酸溶液时
pH=3的弱酸与pH=11氢氧化钠溶液等体积混合,弱酸有剩余,一般溶液呈酸性;
pH=3的弱酸与pH=11氨水等体积混合,所得溶液的酸性性取决于电离程度的相对大小,
若弱酸的电离程度大于氨水,则等体积混合后,氨水剩余,所得溶液一般呈碱性;
若弱酸的电离程度等于氨水,则等体积混合后,所得溶液呈中性;
若弱酸的电离程度小于氨水,则等体积混合后,弱酸剩余,所得溶液一般呈酸性.
点评 本题考查了酸、碱混合后的定性分析,难度中等,注意pH为3的某酸溶液分为强酸溶液和弱酸溶液两种情况,pH=3的弱酸与pH=11氨水等体积混合,所得溶液的酸性性取决于电离程度的相对大小.


科目:高中化学 来源: 题型:选择题
| A. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量BaCl2的溶液中:Mg2+、NH4+、SO42-、NO3- | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-己炔、甲苯、十一烷 | B. | 乙醇、苯、溴苯 | ||
| C. | 乙二醇、乙醛、硝基苯 | D. | 溴苯、四氯化碳、乙酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KOH是氧化剂 | |
| B. | Cl2发生还原反应 | |
| C. | Fe(OH)3是还原剂 | |
| D. | 生成1 mol K2FeO4转移6 mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸具有脱水性 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠存放于煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
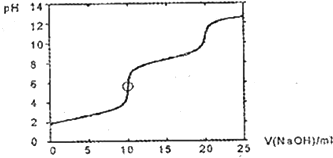
| A. | H2SeO3 | B. | H2SeO3和HSeO3- | C. | HSeO3- | D. | HSeO3-和SeO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 酸性 |
| Na+< O2- | H2SO4<HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com