
| A、明矾和Cl2常用于自来水的净化和杀菌消毒,两者的反应原理相同 |
| B、工业上制备镁是用电解熔融的MgCl2来完成的 |
| C、131I是质子数为131的一种核素 |
| D、用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3 |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、向沸水中滴加FeCl3饱和溶液,继续煮沸至溶液呈红褐色可制Fe(OH)3胶体 |
| D、用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,201.4g |
| C、1000mL,201.4g |
| D、500mL,212g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2Y3 |
| B、XY |
| C、X3Y |
| D、XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、过滤、萃取、蒸馏 |
| B、萃取、结晶、蒸馏、分液 |
| C、蒸馏、萃取、分液、结晶 |
| D、分液、结晶、蒸馏、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、先加KMnO4酸性溶液,再加银氨溶液,微热 |
| B、先加溴水,再加KMnO4酸性溶液 |
| C、先加入足量的新制Cu(OH)2悬浊液,煮沸,酸化后再加溴水 |
| D、先加足量银氨溶液,微热,酸化后再加KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 催化剂 |
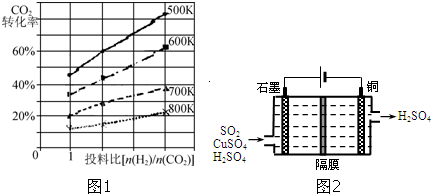
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com