


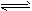
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:山东省日照市2011届高三一模理综化学试题 题型:058
碳和碳的化合物在生产生活实际中应用广泛.运用化学反应原理研究碳的氧化物的性质具有重要意义.
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数K=4.7×10-8.写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式________;
(2)下图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图.电池总反应为2CH3OH+3O2![]() 2CO2+4H2O.该装置放电时________(填“a”或“b”)为电池的负极,其电极反应式为________;
2CO2+4H2O.该装置放电时________(填“a”或“b”)为电池的负极,其电极反应式为________;
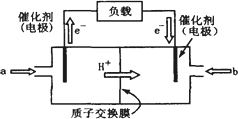
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置.
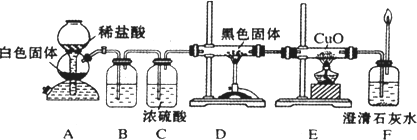
已知
:C+H2O CO+H2 CO+H2O
CO+H2 CO+H2O CO2+H2
CO2+H2 C+CO2
C+CO2试回答下列问题:
①装置B中最适宜的试剂是________,必须用装置C吸收气体中的水蒸气的理由是________;
②根据该实验中的________现象,可证明
CO具有还原性;③若要根据装置
F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置与________之间(填字母标号)连接下图中的________装置(选填序号).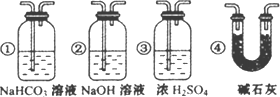
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O22CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2OCO+H2 CO + H2O
CO2 + H2 C + CO2
2CO
试回答下列问题:
① 装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
② 根据该实验中的 现象,可证明CO具有还原性;
③ 若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
查看答案和解析>>
科目:高中化学 来源:2011届山东省日照市高三第一次模拟考试(理综)化学部分 题型:实验题
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka = 4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;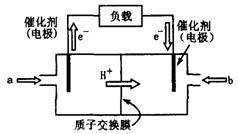
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示 意图。电池总反应为2CH3OH+3O2
意图。电池总反应为2CH3OH+3O2 2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为 ;
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。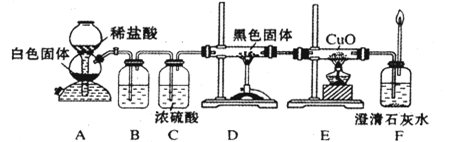
已知:C + H2O CO+H2 CO + H2O
CO+H2 CO + H2O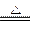 CO2 +
CO2 +  H2 C + CO2
H2 C + CO2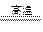 2CO
2CO
试回答下列问题:
①装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
②根据该实验中的 现象,可证明CO具有还原性;
③若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
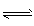 2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数(K)___________ ; 在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常数(K)____________(填增大、减小、不变),其反应的正反应速率 ___________(填增大、减小、不变);温度升高_________(填有利或不利于)电池将化学能转化为电能。 
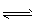 CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题:
CO2(g)+H2(g)。 CO的转化率随时间变化关系如图,回答下列问题: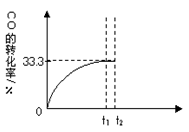
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com