
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。向甲、乙两个体积都为1.0L的恒容密闭容器中均充入2.0molNO2和1.0molO3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表。下列说法不正确的是( )
N2O5(g)+O2(g)。向甲、乙两个体积都为1.0L的恒容密闭容器中均充入2.0molNO2和1.0molO3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表。下列说法不正确的是( )
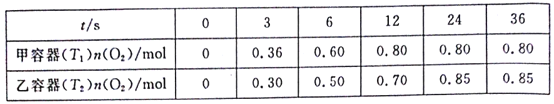
A.T1<T2
B.该反应△H<0
C.甲容器在温度为T1时的平衡常数为20mol·L-1
D.乙容器中,0~3s内的平均反应速率v(NO2)=0.2mol·L-1·s-1
【答案】A
【解析】
A.图表数据可知,甲容器中达到平衡时间短,反应的温度高T1>T2, A错误;
B.图表数据可知,甲容器中达到平衡时间短,反应的温度高,升温平衡向吸热反应方向进行,甲中平衡时氧气的物质的量小于乙容器,则该反应△H<0,B正确;
C.对于甲容器,发生反应2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应达到平衡时n(O2)=0.8 mol,n(N2O5)=n(O2)=0.8 mol,反应消耗n(O3)=0.8 mol,消耗n(NO2)=2×0.8 mol=1.6 mol,所以平衡时n(NO2)=2.0 mol-1.6 mol=0.4 mol,n(O3)=1.0 mol-0.8 mol=0.2 mol,反应容器的容积是1L,所以各种物质的平衡时的物质的量为物质的平衡浓度,则该反应的化学平衡常数K=
N2O5(g)+O2(g),反应达到平衡时n(O2)=0.8 mol,n(N2O5)=n(O2)=0.8 mol,反应消耗n(O3)=0.8 mol,消耗n(NO2)=2×0.8 mol=1.6 mol,所以平衡时n(NO2)=2.0 mol-1.6 mol=0.4 mol,n(O3)=1.0 mol-0.8 mol=0.2 mol,反应容器的容积是1L,所以各种物质的平衡时的物质的量为物质的平衡浓度,则该反应的化学平衡常数K=![]() =20,C正确;
=20,C正确;
D.乙容器中,0~3s内的平均反应速率v(NO2)=2v(O2)=2× =0.20 mol/(L·s),D正确;
=0.20 mol/(L·s),D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】有两种气态烃组成的混合气完全燃烧后所得到的CO2和H2O的物质的量随混合烃的总物质的量的变化如下图所示,则下列对混合烃的判断正确的是
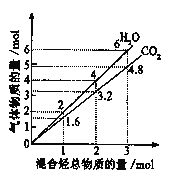
①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷
A.①②⑤B.②④C.②⑤D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒容密闭容器中充入1 mol X 和1 mol Y,发生反应 X(g)+2Y(g)![]() Z(g)+W(s),下列选项不能说明反应已达平衡状态的是
Z(g)+W(s),下列选项不能说明反应已达平衡状态的是
A.v正(X)=2v逆(Y)B.气体平均密度不再发生变化
C.容器内压强不再变化D.X的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡的描述,不正确的是( )
A.向反应体系Cl2(aq)+H2O(l)![]() HCl(aq)+HClO(aq)中加入NaOH溶液,颜色变浅
HCl(aq)+HClO(aq)中加入NaOH溶液,颜色变浅
B.恒容条件下,升高反应体系2NO2(g)![]() N2O4(g) △H<0的温度,颜色变深
N2O4(g) △H<0的温度,颜色变深
C.一定温度下,向体积不变的反应体系2HI(g)![]() H2(g)+I2(g)中加入HI,颜色变深
H2(g)+I2(g)中加入HI,颜色变深
D.一定温度下,向体积不变的反应体系CaCO3(s)![]() CaO(s)+CO2(g)中通入CO2,平衡后c(CO2)增大
CaO(s)+CO2(g)中通入CO2,平衡后c(CO2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下有反应:C6H5OH +CH3I → C6H5OCH3 + HI
![]() +CH3CH2OH→HOCH2CH2OCH2CH3
+CH3CH2OH→HOCH2CH2OCH2CH3
环氧树脂是一类性能优良、使用广泛的聚合物,合成过程可表示如下(反应条件均略去):

双酚A与![]() (环氧氯丙烷)在一定条件下制得环氧树脂:
(环氧氯丙烷)在一定条件下制得环氧树脂:
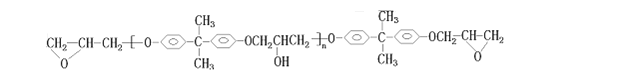
(1)操作①是______;操作②是______(选填序号)
a.分馏 b.裂化 c.裂解
(2)反应①是______;反应②是______(填反应类型)。
(3)完成反应③的化学方程式:_______________________________________________。
(4)在生成环氧树脂的同时还有____________生成。
(5)环氧树脂两端的环氧键可与某些物质反应,使链与链连接起来,这种物质可以是_____(填序号) a.乙醇 b.乙二醇 c.1-丙醇
(6)环氧氯丙烷有多种同分异构体,其中能起银镜反应的有_______种,写出其中一种的系统命名_______________;若双酚A中的H原子被1个D原子取代,则取代的产物有_____种。
(7)工业上由苯制取苯酚有多种方法,如:
方法一: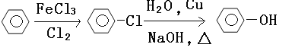
方法二:![]() +2NO
+2NO +N2
+N2
方法二优于方法一之处有:____________________________________________(答一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔奖授予了在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、Al等,处理该废料的一种工艺如图所示:

(1)Li的原子结构示意图为_____________,LiCoO2中Co的化合价为_______。
(2)“碱浸”时Al溶解的离子方程式为__________________________________。
(3)“酸溶”时加入H2O2的目的是______________________________________。
(4)“沉钴”的离子方程式为___________________________________________。
(5)配制100 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器出玻璃棒、烧杯外,还有_____。
(6)取CoC2O4固体4.41g在空气中加热至300 ℃,得到的钴的氧化物2.41g,则该反应的化学方程式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸、氢硫酸、碳酸在常温下的电离常数如下表:
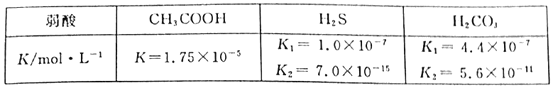
(1)能证明CH3COON是弱酸的事实是___。
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
(2)煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为___。
(3)t℃时,0.0lmol·L-1NaOH溶液的pH=11,则该温度下,水的离子积Kw=___mol2·L-2;该温度下,将pH之和为13的NaOH溶液和CH3COOH溶液等体积混合,所得溶液呈___(填“酸”、“碱”或“中”)性。
(4)在室温下,用蒸馏水稀释0.0lmol·L-1CH3COOH溶液,下列各项呈减小趋势的是___。
A.![]()
B.![]()
C.溶液中c(H+)和c(OH-)的乘积
D.溶液导电性
E.水的电离程度
(5)25℃时,向1m30.1mol·L-1H2S溶液(pH=4)中加入FeSO4·7H2O晶体,当开始生成沉淀时,加入FeSO4·7H2O晶体的质量为___g。
[已知:Ksp(FeS)=6.3×10-18mol-1·L-2,忽略混合过程中的体积变化]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤隔绝空气加强热(干馏)可得到焦炭、煤焦油、粗氨水和焦炉气。某焦炉气组成如下:
成分 | 氢气 | 甲烷 | 乙烯 | 丙烯 |
质量分数(%) | 20 | 56 | 14 | 10 |
将该焦炉气通过足量的溴水后,所得混合气体的平均相对分子质量约为
A.5.63B.7.02C.7.41D.10.12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧的热化学方程式: ____________________。
(2)合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
2NH3(g)ΔH=a kJ·mol-1,反应过程的能量变化如图所示:
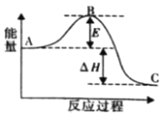
①该反应通常用铁作催化剂,加催化剂会使图中E______(填“变大”或“变小”),E的大小对该反应的反应热有无影响?______(填“有”或“无”)。
②有关键能数据如下:
化学键 | H—H | N—H | N≡N |
键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a为____________。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①N2(g)+2O2(g)=2NO2(g) △Η1=a kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △Η2=bkJ/mol
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com