
在500mL 0.2 mol·L-1的稀硝酸中加入1.92g铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(1)NO在标准状况下的体积是0.448L;(2)反应后溶液中H+的物质的量浓度是0.04mol/L。
解析试题分析:(1)(5分) n(HNO3)= V·c =(500mL÷1000mL/L)×0.2 mol·L-1=0.1 mol
n(Cu)=" m/M" =" 1.92g" ÷64 g.mol-1 = 0.03mol 可知,稀硝酸过量。
设生成的一氧化氮物质的量为x ,消耗HNO3的物质的量为y,
则3 Cu + 8 HNO3 =" 3" Cu(NO3)2 + 2 NO ↑+ 4 H2O
3 8 2
0.03mol y x
得:2 : x ="3:" 0.03mol 解得:x =" 0.02" mol y =" 0.08" mol.
一氧化氮在标准状况下的体积:V = n·Vm =" 0.02" mol × 22.4L/mol = 0.448L
(2)(2分)反应后溶液中剩余的稀硝酸物质的量:
n(HNO3剩)=" 0.1" mol-0.08 mol ="0.02" mol
反应后溶液中H+的物质的量浓度:
c =" n/V" =" (" 0.02 mol / 500mL) ×1000mL/L = 0.04mol/L.
考点:考查物质的量在化学反应中的应用的相关知识点。


科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(3)工业上可以通过如下图所示的流程制取纯硅: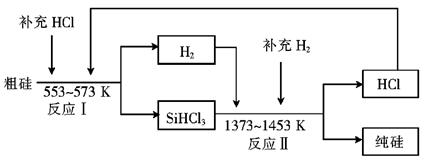
①若反应I为 Si(粗)+3HCl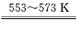 SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。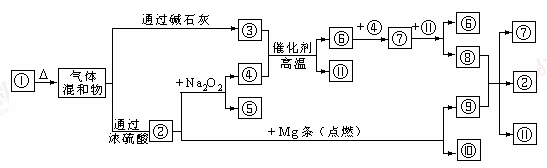
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为 ;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是 。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到2.24L(标准状况)气体。过滤残留固体,干燥后称量,质量减轻了7.5g。
(1)求参加反应的锌粉的物质的量
(2)原硫酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。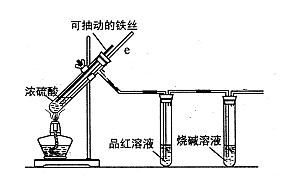
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)固体硝酸盐加热易分解且产物较复杂。以Mg(NO3)2为研究对象,四个学习小组拟通过实验探究其热分解的产物,分别提出如下4种猜想:
甲组:Mg(NO2)2、NO2、O2 乙组:MgO、NO2、O2
丙组:MgO、NO2、N2 丁组:Mg3N2、O2
(1)实验前,小组成员经讨论认定 组的猜想一定不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对其他小组猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略)进行探究: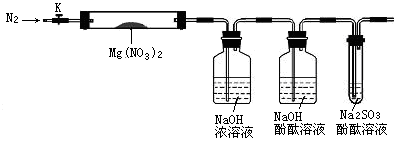
A B C D
(2)实验过程
①简述检验该装置气密性的方法 。
②称取硬质试管A的质量为18.0g,试管A与Mg(NO3)2固体共21.8 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A中有红棕色气体生成,C中有气泡。
④待样品完全分解,A装置冷却至室温、称量,测得硬质试管A和剩余固体的总质量为19.0g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①证明一定有O2生成的依据是 ,与此相关的化学原理为(用化学方程式表示) 。
根据实验现象和剩余固体的质量经分析可初步确认猜想_______组结论是正确的。
②一位同学认为上述装置不能确认分解产物中有O2,他的理由你认为可能是 , 如果需改进装置,应该 。
(4)据以上分析,Mg(NO3)2分解的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)化学小组同学依据化学反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。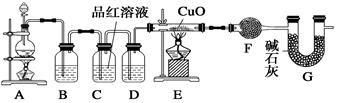
请回答下列问题:
(1)装置A中添加液体的仪器名称为 ;98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是 ;
(2)请写出产生氢气的反应的离子方程式 ;
(3)①装置B是为了吸收SO2,则不能选用下列试剂中的 (填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
②可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。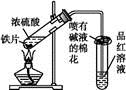
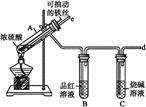
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。(3)能说明有SO2气体产生的实验现象是 。(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 |
| C.KSCN溶液 | D.KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com