
| A. | Cl- 和NO3-一定来自不同的工厂 | B. | SO42- 和NO3-可能来自同一工厂 | ||
| C. | Ag+ 和Na+ 可能来自同一工厂 | D. | Na+ 和NO3-一定来自同一工厂 |
分析 将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,说明甲乙两厂的废水能反应生成沉淀,从离子能否大量共存的角度分析,可假设甲厂含有Ag+,则一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与乙厂,因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于甲厂,根据溶液呈电中性可知,甲厂一定存在NO3-;所以甲厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,乙厂含有的离子为:Na+、Cl-、SO42-、OH-,以此解答该题.
解答 解:假设甲厂有银离子,那么甲厂就一定不含有氯离子、硫酸根离子和氢氧根离子,根据溶液显电中性可知:甲厂一定含有硝酸根离子;乙厂中含有氯离子、硫酸根离子和氢氧根离子,故不含有银离子、铁离子和钡离子,根据溶液显电中性可知:乙厂一定含有钠离子;故甲厂还含有铁离子和钡离子.故甲厂含有的离子为:Ag+、Ba2+、Fe3+、NO3-;乙厂含有的离子为:Na+、Cl-、SO42-、OH-;或者甲和乙顺序相反.
故选A.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,能够根据离子反应条件判断离子是否能够共存,正确理解题干信息为解答本题的关键.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:多选题
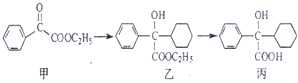
| A. | 化合物甲中的含氧官能团有 羰基和酯基 | |
| B. | 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 | |
| C. | 化合物乙中含有1个手性碳原子 | |
| D. | 在NaOH醇溶液中加热,化合物丙可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等PH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| B. | 等体积、等物质的量浓度的NaCl和NaClO溶液中离子总数(N):N(NaCl)<N(NaClO) | |
| C. | 将10mol0.1mol•L-1Na2CO3溶液逐渐滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| D. | 室温下,向0.1mol•L-1的醋酸钠溶液中通入氯化氢气体,使溶液的pH=7:>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移电子的总数为0.3mol | |
| B. | 反应过程中,消耗硝酸的物质的量为0.3mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为100mL | |
| D. | 开始加入合金的质量可能为3.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸:CH3COOH、H2SO3、NaHCO3、HF | B. | 碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2 | ||
| C. | 盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2 | D. | 酸性氧化物:CO、CO2、SO2 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若HA 的电离能力大于A-的水解能力,则有c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
| B. | 若A-的水解能力大于HA 的电离能力,则有c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+) | |
| C. | 无论该溶液呈酸性还是碱性,都有 c(Na+)+c(H+)=c(A-)+c(OH-) | |
| D. | 无论该溶液呈酸性还是碱性,都有2c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 外观 | 在空气中加热时的现象 | 产物水溶液的酸碱性 |
| X | 黑色粉未 | 燃烧时呈炽红色并发出火花,放出无色气体G | 微弱酸性 |
| Y | 淡黄色晶体 | 首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 | 弱酸性 |
| Z | 银白色固体 | 燃烧,产生黄色火焰,生成浅黄色固体F | 强碱性 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com