
����Ŀ������ʵ��������ͻ������ȷ����( )
ѡ�� | ʵ�� | ���ͻ���� |
A | ��ij��Һ����ͨ��CO2���壬�ȳ��ְ�ɫ��״����������ͨ��CO2���壬��ɫ��״�������ܽ⣬֤������Һ�д���AlO2�� | Al(OH)3�������������������̼����Һ |
B | ��������ˮ�м���̼��Ʒ�ĩ����ֽ��裬��ˮ��Ư������ǿ | ��ˮ��HClO�����ʵ���Ũ������ |
C | �������ܽ��ܽ���CCl4�еĵ������� | ��Ϊ�����������ȷ������ |
D | ��Fe(NO3)2��Һ�е��������ữ��H2O2��Һ������Һ��Ϊ��ɫ | �����ԣ�H2O2 > Fe3+ |
A.AB.BC.CD.D
���𰸡�B
��������
A. ƫ��������Ӻ���������̼��Ӧ����̼��������Ӻ�����������˵����������������̼��������Һ����A����
B. Cl2 + H2O ![]() HCl + HClO�������̼��Ʒ�Ӧ�����Ȼ��ơ�������̼��ˮ���Ӷ��ٽ������ܽ⣬������Һ�ʴ�����Ũ����������Һ��Ư������ǿ����B��ȷ��
HCl + HClO�������̼��Ʒ�Ӧ�����Ȼ��ơ�������̼��ˮ���Ӷ��ٽ������ܽ⣬������Һ�ʴ�����Ũ����������Һ��Ư������ǿ����B��ȷ��
C. �������ܽ��ܽ���CCl4�еĵ�������������۵�������Ȼ�̼���������Ȼ�̼������õ�����C����
D. �����ܽ�������������Ϊ�����ӣ����Բ����ж������ԣ�H2O2 > Fe3+����D����
������������ΪB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
(1)�����dz��������ᡣ���з����У�����ʹ������Һ��CH3COOH����̶��������_______��
A. �μ�����Ũ���� B. ����Һ C. ��ˮϡ�� D. �������������ƾ���
(2)��0.1mol��L-1NaOH��Һ�ֱ�ζ������Ϊ 20mL��Ũ�Ⱦ�Ϊ0.1mol��L-1������ʹ�����Һ�� �õ��ζ���������Һ pH ����� NaOH ��Һ������仯�������ζ����ߡ�

�ٵζ������������_______(����I������II��)��
��ͼI�� V=10 ʱ����Һ�е�c(Na+)________c(A-)��(����>��������������<��������A-�����������)
(3)�±�Ϊijͬѧ���� 25��ʱ���ס���������Һ�� pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =_________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ�����ǡ����ȫ��Ӧ�����ĵ������������_______�ҡ�(����>��������������<��)
�ۼס�����Һ����ˮϡ�� 10 ����������Һ�� pH����______�ҡ�(����>��������������<��)
(4)�±��Ǽ��ֳ�������ĵ��볣��
��ѧʽ | CH3COOH | H2SO3 | HClO | H2CO3 |
���볣�� | 1.8��10-5 | K1=1.23��10-2 K2=6.6��10-8 | 3.0��10-8 | K1=4.4��10-7 K2=4.7��10-11 |
���·�Ӧ��Ӧ�����ӷ���ʽ��ȷ����_______��
A��Na2CO3��Һ��������SO2��![]() +SO2+H2
+SO2+H2![]() +
+![]()
B��Ư��Һ��Ч��ԭ����ClO-+CO2+H2O = HClO+![]()
C������������Һ��������SO2��ClO-+SO2+H2O = HClO+![]()
D�������ˮ���е�CaCO3��2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ٺ͢�Ϊ���������ͬ�Ĺ̶�������ͼ����![]() ������
������![]() ���ֱ��ʾ��ԭ�Ӻ���ԭ�ӣ�������˵����ȷ���ǣ� ��
���ֱ��ʾ��ԭ�Ӻ���ԭ�ӣ�������˵����ȷ���ǣ� ��
�� ��
��
A.�����е�![]() Ϊ4mol�����������ԭ������Ϊ
Ϊ4mol�����������ԭ������Ϊ![]() ��
��
B.�ٺ͢������������֮��Ϊ1��8
C.![]() ��
��![]() ���ܷ������Ϸ�Ӧ���������ܷ����û���Ӧ
���ܷ������Ϸ�Ӧ���������ܷ����û���Ӧ
D.���������¶Ⱥ�ѹǿ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ����Ԫ��ԭ�ӽṹ���������±���ʾ
Ԫ�� | �ṹ������ |
A | Ԫ��A�ڵ��������м����Ӱ뾶��С |
B | Bԭ���������������ڲ��������0.6 |
C | ʹ����㷺�Ľ���Ԫ��C���γ������Ȼ������Է�������֮��Ϊ35.5 |
D | Ԫ��D��Bͬ���壬�Ҵ���������D���������ϼ� |
E | Ԫ��E�����ڱ���λ����A�壬������Ϊ����������A��Ҳ��һ������ |
F | Ԫ��F��Bͬ���ڣ�������������ˮ������A��B������������ˮ������ܷ�Ӧ |
(1)Ԫ��C�����ڱ��е�λ����____Ԫ�أ�Ԫ��E�γɵ�һ�ּ�������֧������Ԫ��E������A������һ�۵㣬�����ӵĽṹʾ��ͼΪ___��
(2)Ԫ��E��D����ԭ�Ӹ�����2��1��1��1�γ����ֻ�����X��Y������X��Y���������ʵ�ʵ�鷽��Ϊ __��E��B�γɵ�һ�ֻ�����Z��X��Y�е�һ�ֵ���������ͬ���ܷ�����ѧ��Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��___(����Ӧ��ѧʽ��ʾ)��
(3)�뻭��������F2B2�ĵ���ʽ��_____���û������к��еĻ�ѧ��������___��
(4)Ԫ��A��Ԫ��F��ȣ������Խ�ǿ����_________ (��Ԫ�ط��ű�ʾ)�����б�����ȷ����֤����һ��ʵ����___(����ĸ����)��
a����Ӧ�������ᷴӦʱ��ÿ��Aԭ�ӱ�ÿ��Fԭ��ʧ���Ӷ�
b����Ӧ������ͬŨ�����ᷴӦʱ��F��A���ҵö�
c��A���������۵��F���������۵��
d��F�ɽ�A��������Һ���û�����
e������������Ӧ��ˮ����ļ���F��A��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
(1)�ڢ�KNO3 ��K2CO3 ��(NH4)2SO4 ��������Һ�У������³����Ե���_____(�����)�������Ե�ԭ����_____(�û�ѧ�����ʾ)��
(2)�����Ȼ���(SbCl3)��������ˮ�����ɰ�ɫ����������Һ pH<7�������� SbCl3 ��Һ����ȷ������_____
(3)ij�¶��£����� AgCl ����� AgCl ������Һ�м�������ϡ���ᣬ�� c(Ag+)_____(��������������С����������������ͬ)��Ksp_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��ԭ��أ�����˵����ȷ����(����)
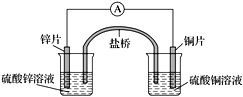
A. ���Ӵ�п�缫ͨ������������ͭ�缫
B. �����е�������������ͭ��Һ��Ǩ��
C. ͭ�缫������ԭ��Ӧ����缫��Ӧ��2H����2e��===H2��
D. ȡ�����ź������Ի�ƫת��ͭ�缫�ڷ�Ӧǰ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ḻ��ʵ�������ϣ�
��1����»Ὣ��2014��8�����Ͼ����С���»Ὠ����ʩʹ���˴������ܲ��ϣ������ˡ���ɫ��¡������
��������´幤�̵ĸ��ȱ��²��Ͼ۰�������___������ĸ����
a���л��߷��Ӳ��� b�����ǽ������� c����������
�����������ǽ�ĸ��ϱ��²��ϲ������Ͻ����ߡ��й����Ͻ��������ȷ����___������ĸ����
a��ǿ��С b����ʴ c���ܶȴ�
����»�������˫�������˲���Ļǽ��ơ����첣������Ҫԭ��Ϊ���ʯ��ʯ��___������ĸ����
a�����ɰ b��ʯӢ c��ˮ����
��2�������д����л�ѧ����ѧ���������ǵġ��¡�ʳ��ס���С�֮�С�
�����Ͻ��������г����IJ��ϣ������ܶ�С��ǿ�ȸߵ��������ܡ����ڿ����в��������ԭ����___��
�ڲ��������dz��õĽ������ϡ���ͨ��������Na2SiO3��CaSiO3��___��������ɵģ�������Ʒ�����ɷ�����ѧ��ʴ���ڳ�ʪ�Ŀ����л��ܷ���___��ʴ�����ɵ��������Ҫ�ɷ���___���ѧʽ����
��3����������һ�������²��ϣ�������������������������д���ߴ���͵�����1300�淴Ӧ�Ʊ�������Ļ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ԭ�ϵĽṹ��ʽ��ͼ��ʾ�����й��ڸ��л����˵����ȷ���ǣ� ��
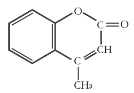
A.1 mol����������ܺ�5mol H2�����ӳɷ�Ӧ
B.��ʹ����KMnO4��Һ��ɫ���ܷ����ӳɷ�Ӧ��ȡ����Ӧ
C.�÷���������ԭ�Ӷ����ܹ�ƽ��
D.�����ʵķ���ʽΪC10H10O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000 mol/L��NaOH����Һ�ζ�20.00 mL0.1000 mol/L��HCl��Һ���ζ�������ͼ�������й�˵����ȷ����( )

A.ָʾ����ɫʱ��˵����Ӧ���ᡢ��ǡ�õ����ʵ�����Ӧ
B.���ﵽ�ζ��յ�ʱ�Ŵ���c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.�ﵽ�ζ��յ�ʱ���ü�����ָʾ������NaOH��Һ������÷�̪��
D.��֪H+(aq)+OH-(aq)=H2O(l)��H=-57.3 kJ/mol�������ζ�ǡ���к�ʱ���ų�114.6J������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com