
【题目】我国明崇祯年间《徐光启手迹》记载了《造强水法》 :“绿钒(FeSO47H2O)五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,次用铁作锅,…… 锅下起火,取气冷定,开坛则药化为水……。用水入五金皆成水,惟黄金不化水中,加盐则化。……强水用过无力……”。下列有关解释错误的是
A.“将矾炒去,约折五分之一”后生成FeSO44H2O
B.该方法所造“强水”为硝酸
C.“惟黄金不化水中,加盐则化”的原因是加人 NaCl溶液后氧化性增强
D.“强水用过无力”的原因是“强水”用过以后,生成了硝酸盐溶液,其氧化性减弱
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
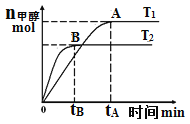
A.CO合成甲醇的反应为吸热反应B.平衡常数![]()
C.该反应在![]() 时的平衡常数比
时的平衡常数比![]() 时的小D.处于A点的反应体系从
时的小D.处于A点的反应体系从![]() 变到
变到![]() ,达到平衡时
,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是
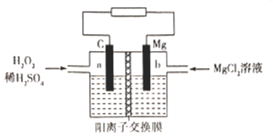
A.a极发生还原反应B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧D.b极电极反应式为Mg-2e-=Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态O原子的电子排布图为_______,基态O原子电子占据最高能级的电子云轮廓图为____形,O原子最外层电子的运动状态有_____种。
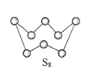
(2)下图为S8的结构,该分子中S原子的杂化轨道类型为______________。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的价层电子数___________。
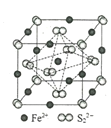
(4)FeS2晶体的晶胞如图所示。晶胞中有Fe2+_____个,有S22-_____个,晶胞中Fe2+位于S22-所形成的____(填空隙名称)的体心。晶胞边长为a nm、FeS2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________gcm﹣3。
(5)在硅酸盐中,SiO44﹣四面体(如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长层状结构的多硅酸根;其中Si原子的杂化形式为____。该多硅酸根的化学式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
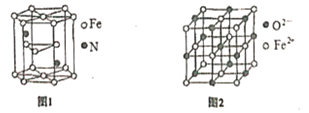
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
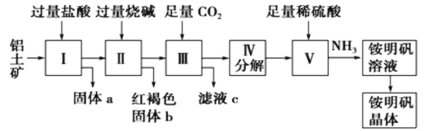
请回答下列问题:
(1)固体a的化学式为___,固体b化学式为___,Ⅲ中通入足量CO2气体发生反应的离子方程式为___。
(2)由Ⅴ制取铵明矾溶液的化学方程式为___。
(3)由I→II→III→IV都要用到的分离方法是___,由铵明矾溶液中制铵明矾晶体的操作是___,___,过滤,洗涤,干燥保存。
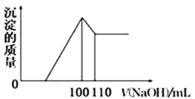
(4)向10gFe2O3、SiO2和Al2O3的混合物中,加入100mL稀硫酸,过滤后,向滤液中加入10mol/LNaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。则混合物中三氧化二铝的质量分数为___。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为Na2Fe5(OH)2Si8O22,该物质中+2价铁与+3价铁的物质的量之比为___。将mg该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为Fe2+,过滤后滤液用cmol/L的KMnO4酸性溶液与Fe2+反应,用去VmL溶液。该矿石中铁元素的质量分数为___(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO 等)湿法制取金属锌的流程如图所示,回答下列问题。

已知:Fe的活泼性强于Ni。
(1)ZnFe2O4可写成ZnOFe2O3,则ZnFe2O4与H2SO4反应的化学方程式___。
(2)“净化Ⅰ”操作分为两步:
①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是_____(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeC13溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是___。
(3)“净化Ⅰ”生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____。
(4)“净化Ⅱ”中加入过量Zn的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )
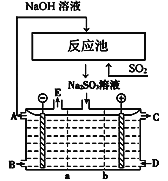
A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com