
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”。生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B.“水热反应”是一种复杂的化学变化
C.火力发电厂可望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
科目:高中化学 来源: 题型:
有机物M是一种重要的化工原料,已知M分子式为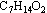 ,1mol M最多消耗46g金属钠。M可通过下列路线合成(某些反应的反应物和反应条件未列出):
,1mol M最多消耗46g金属钠。M可通过下列路线合成(某些反应的反应物和反应条件未列出):

(1)按要求写出结构简式:
A B C
D E M
(2)写出反应①、④、⑦的化学方程式:
① ;
④ ;
⑦ 。
⑶ ⑥的反应类型是___________。
⑷写出M中所含官能团的名称 。
查看答案和解析>>
科目:高中化学 来源: 题型:

已知某反应A(g)+B(g)===C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
( )
A.向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________________
___________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为________。
(3)铝电池性能优越,AlAgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为_________________________________________
_______________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应:X(g)+3Y(g)===2Z(g),有关下列图像的说法不正确的是( )

A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·(L·s)-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:
2MnO +5C2O
+5C2O +16H+
+16H+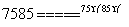 2Mn2++10CO2↑+8H2O。
2Mn2++10CO2↑+8H2O。
(1)若用托盘天平称取W g Na2C2O4晶体,称量开始时和称量结束时的共同操作步骤是____________________。若需移动游码,应用__________拨动游码。
(2)若将W gNa2C2O4配成100 mL标准溶液,移取20.00 mL置于锥形瓶中,则酸性KMnO4溶液应装在__________(填“酸式”或“碱式”)滴定管中。
判断滴定达终点的现象是____________________。
(3)若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为____________________________(填表达式)。

(4)若滴定完毕立即读数,测定的KMnO4溶液的浓度__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com