
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
分析 NaHCO3溶液中HCO3-既能水解又能电离:HCO3-+H2O?H2CO3+OH-;
HCO3-?CO32-+H+;
且水解程度大于其电离程度,故溶液显弱碱性,据此分析.
解答 解:NaHCO3溶液中HCO3-既能水解又能电离:HCO3-+H2O?H2CO3+OH-;
HCO3-?CO32-+H+;
且水解程度大于其电离程度.
A、由于水解程度大于电离程度,故该溶液中 c(H2CO3)>c(CO32-),故A正确;
B、HCO3-的水解显碱性,电离显酸性,而水解程度大于其电离程度,故溶液显弱碱性,即pH大于7,故B正确;
C、根据电荷守恒可知,溶液中的离子有:N(Na+)+N(H+)=2N(CO32-)+N(HCO3-)+N(OH-),故可知,该溶液中阳离子总数大于阴离子总数,故C错误;
D、根据HCO3-的电离方程式和水解方程式可知,其水解平衡常数Kh=$\frac{c({H}_{2}C{O}_{3})•c(O{H}^{-})}{c(HC{{O}_{3}}^{-})}$,其电离平衡常数Ka=$\frac{c(C{{O}_{3}}^{2-})•c({H}^{+})}{c(HC{{O}_{3}}^{-})}$,故有:
$\frac{Ka}{Kh}$=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c({H}_{2}C{O}_{3})•c(O{H}^{-})}$,温度不变,此值不变,而加水稀释时,溶液碱性变弱,故c(OH-)变小,则$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$变大,故D错误.
故选CD.
点评 本题考查了弱酸的酸式盐中的电离和水解平衡的相对强弱决定了酸式盐溶液的酸碱性,综合性较强,注意加水稀释K不变,据此分析离子浓度比值的变化.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有⑤ | C. | ③④⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与氢氧化钙混合加热:NH4++OH-=NH3↑+H2O | |
| B. | 铁片溶于足量稀硝酸:Fe+2H+=Fe2++H2↑ | |
| C. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ | |
| D. | 稀氨水与稀盐酸混合:NH3?H2O+H+=NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10 mL时,2c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (2)H2H:H(3)MgCl2
(2)H2H:H(3)MgCl2
 (5)CO2
(5)CO2 (6)Na2O
(6)Na2O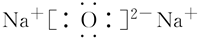
 ;O=C=O.
;O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
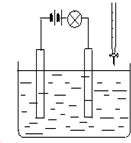 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐渐加入氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com