
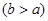 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |


科目:高中化学 来源:不详 题型:单选题
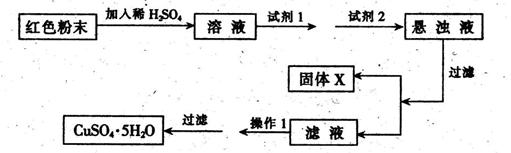
| A.不同浓度的硝酸与铜反应 |
| B.稀硫酸与纯碱或小苏打反应 |
| C.铝与氢氧化钠溶液或盐酸反应 |
| D.H2O2在不同催化剂作用下分解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

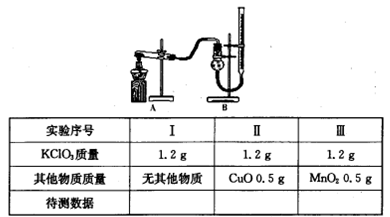
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③⑤ | C.②④ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
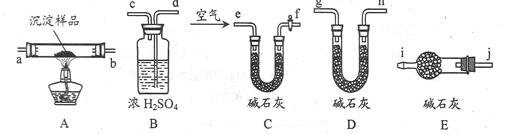
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→___→___→___→___→j→i顺序连接。 | | |
| ②称取一定质量的沉淀______________________,然后___________________,冷却后再称量B、D的质量分别为m3、 m4 | (1)若m1 = m3,m2 < m4 (2)若m1___m3,m2___m4 (3)若ml___m3,m2___m4 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验变量 实验序号 | 银氨溶液 /mL | 乙醛的量 /滴 | 水液温度/℃ | 反应混合液的PH | 出现银镜时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
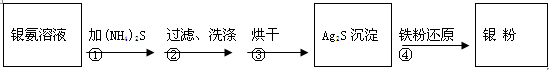
 2 Ag+ FeCl2+H2S↑。
2 Ag+ FeCl2+H2S↑。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
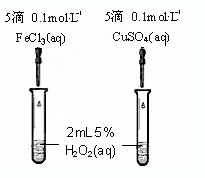
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验方案 | 实验现象 |
| ①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置 | A.浮在水面上,熔成小球,不定向移动,随之消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫色 |
| ③将溴水滴加到NaI溶液中,振荡后,再加入适量CCl4,再振荡,静置 | C.浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层橙色 |
| 实验方案 | 实验现象 | 化学方程式 |
| ① | | |
| ② | | |
| ③ | | |
| ④ | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com