
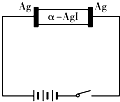
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如图所示实验.下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如图所示实验.下列有关说法不正确的是( )| A、阳极反应:Ag-e-═Ag+ |
| B、阴极质量不断增大 |
| C、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| D、若α-AgI是Ag+导电,则通电一段时间后晶体质量减小 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解水制氢气时,用铜作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,且用水洗涤量筒,洗涤液一并注入烧杯 |
| B、除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法 |
| C、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生石灰与水混合的过程只发生物理变化 |
| B、可用丁达尔效应区分溶液与胶体 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电离常数:K(HCN)<Ka2(H2CO3) |
| B、浓度均为0.1mol?L-1的NaCN和NaHCO3溶液的pH:NaCN<NaHCO3 |
| C、浓度均为0.1mol?L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等 |
| D、pH均为10的Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、18g NH
| ||
| B、1mol 任何气体的体积都约是22.4L | ||
| C、NA个H2SO4分子的质量等于H3PO4的摩尔质量 | ||
| D、标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
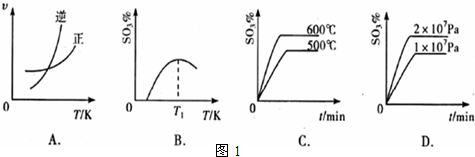
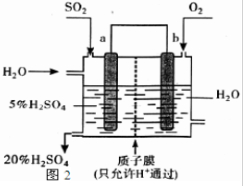
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com