
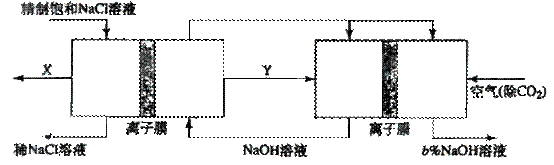

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
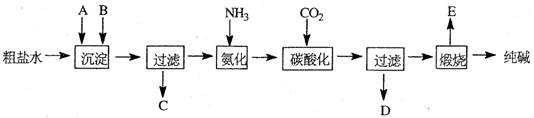
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 CH3OH(g)��H2O(g)����H3
CH3OH(g)��H2O(g)����H3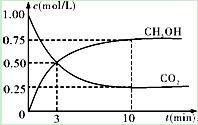
| A����10min������������ٳ���1mol CO2��3mol H2�����ٴδﵽƽ��ʱc(CH3OH)��1.5mol��L��1 |
| B��0��10min�ڣ�������ƽ����Ӧ����Ϊ0.075mol/(L��min) |
| C���ﵽƽ��ʱ��������ת����Ϊ0.75 |
| D�������¶Ƚ�ʹn(CH3OH)/n(CO2)��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ѹǿ(Mpa) ѹǿ(Mpa) ����ƽ ����ƽ�⺬��(%) �¶�(��) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 9 5.4 5.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
| | ��Ӧ���� | ƽ�ⳣ��K | ����������� |
| �仯��� | | | |
| A��0.3mol | B��0.15mol | C����0.15mol | D������0.15mol����0.3mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
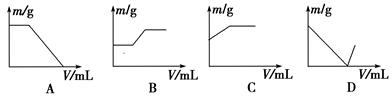
| A��NaOH��Һ����̪��Һ | B����ˮ����̪��Һ |
| C����ˮ��������Һ | D��KMnO4��Һ��ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 Ԫ�ص���������Ϊ26.7%������ΪN��S��
Ԫ�ص���������Ϊ26.7%������ΪN��S���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ķ�ӦʽΪ H2��2e����2H�� | B�������ķ�ӦʽΪ N2+6e��+6H��=2NH3 |
C�������ܷ�Ӧʽ N2+3H2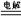 2NH3�� 2NH3�� | D�������ܷ�ӦʽΪ 3H��+ N3��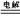 NH3 NH3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com