有X、Y、Z、W、M五种短周期元素,它们满足如下关系:①原子序数依次增大;②ZX4++WX-═ZX3+X2W,且反应物和产物中各微粒的电子总数与M+相等;③Z2与YW分子中质子数相等.回答下列问题:
(1)M单质的蒸气中存在着少量的双原子分子,其电子式为______;实验室中MWX的保存方法是______.
(2)由X、Y、Z、W四种元素组成的离子化合物A,其原子个数比为7:2:1:2,则A为______(写名称),A的水溶液的pH约等于7,其原因是______.
(3)化学式为X5Y2ZW2的化合物B既能与盐酸反应,又能与NaOH溶液反应,且在一定条件下可形成高分子化合物,则B的结构简式为______.
(4)M2W2与FeSO4按物质的量之比1:2混合溶于水中,反应的离子方程式为______.
(5)与M同族的元素M′和M2′W共n g投入到足量的X2W中完全反应,生成物蒸干后得1.25n g化合物M′WX,M′是______(填元素名称).
【答案】
分析:根据ZX
4++WX
-═ZX
3+X
2W,且反应物和产物中各微粒的电子总数与M
+相等,则电子数与NH
4+、OH
-、NH
3、H
2O相等的M
+为Na
+,M为Na,X为H,Z为N,W为O;Z
2与YW分子中质子数相等则Y为C,然后依据元素及其单质、化合物的性质来解答.
解答:解:根据ZX
4++WX
-═ZX
3+X
2W,只能是NH
4++OH
-═NH
3+H
2O,且反应物和产物中各微粒的电子总数与M
+相等,则电子数与NH
4+、OH
-、NH
3、H
2O相等的M
+为Na
+,M为Na,X为H,Z为N,W为O;Z
2与YW分子中质子数相等则Y为C,
(1)M为Na,Na原子的最外层有1个电子,则双原子分子的电子式为Na:Na,M为Na,X为H,W为O,则MWX为NaOH,易吸收水和空气中的二氧化碳反应,则应密闭保存在带橡胶塞的试剂瓶中,
故答案为:Na:Na;密闭保存在带橡胶塞的试剂瓶中;
(2)分子式为C
2H
7O
2N的A为CH
3COONH
4,其所含CH
3COO
-与NH
4+的水解程度相近,导致溶液pH约等于7,
故答案为:醋酸铵(乙酸铵);CH
3COO
-水解与NH
4+水解程度相当;
(3)B的分子式为C
2H
5O
2N,既能与盐酸反应又能与NaOH溶液反应且在一定条件下可生成高分子化合物的物质只能是H
2NCH
2COOH,故答案为:H
2NCH
2COOH;
(4)


2

,



,Na
2O
2为1mol而FeSO
4为2mol时化合价升降相等,则反应可表示为Na
2O
2+2FeSO
4+xH
2O═yNa
2SO
4+zFe
2(SO
4)
3+mFe(OH)
3↓,据Na
+守恒知y=1,再据SO
42-守恒知z=

,进一步据Fe
3+守恒知m=

,最后根据H
+守恒知x=2,整理后改写得到的离子方程式为3Na
2O
2+6Fe
2++6H
2O═6Na
++4Fe(OH)
3↓+2Fe
3+,
故答案为:3Na
2O
2+6Fe
2++6H
2O═6Na
++4Fe(OH)
3↓+2Fe
3+;
(5)设M′的相对原子质量为R,利用极限值法求解:
若n g的物质全为M′时
M′-→M′OH
R R+17
n 1.25n
则

=

,解得R=68,
若n g物质全为M′
2O时
M′
2O-→2MOH
2R+16 2R+34
n 1.25n
则:
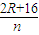
=

,解得R=28,
因为n g物质为M′与M′
2O的混合物,故28<R<68,与Na同族的元素中只有K符合要求,
故答案为:钾.
点评:本题考查位置、结构、性质的应用,明确常见的10电子微粒来推断元素是解答的关键,并熟悉物质的性质来解答,(4)与(5)是学生解答的难点,注意利用待定系数法和极限法来分析.


 2
2 ,
,

 ,Na2O2为1mol而FeSO4为2mol时化合价升降相等,则反应可表示为Na2O2+2FeSO4+xH2O═yNa2SO4+zFe2(SO4)3+mFe(OH)3↓,据Na+守恒知y=1,再据SO42-守恒知z=
,Na2O2为1mol而FeSO4为2mol时化合价升降相等,则反应可表示为Na2O2+2FeSO4+xH2O═yNa2SO4+zFe2(SO4)3+mFe(OH)3↓,据Na+守恒知y=1,再据SO42-守恒知z= ,进一步据Fe3+守恒知m=
,进一步据Fe3+守恒知m= ,最后根据H+守恒知x=2,整理后改写得到的离子方程式为3Na2O2+6Fe2++6H2O═6Na++4Fe(OH)3↓+2Fe3+,
,最后根据H+守恒知x=2,整理后改写得到的离子方程式为3Na2O2+6Fe2++6H2O═6Na++4Fe(OH)3↓+2Fe3+, =
= ,解得R=68,
,解得R=68,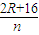 =
= ,解得R=28,
,解得R=28,

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
