
【题目】硫化钠广泛应用于染料工业。请完成下列各题:
(1)![]() 的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
的核外电子排布式_______________,其核外有_______种不同运动状态的电子。写出Na2O的电子式___________,比较Na2O和Na2S的熔点高低:Na2O______Na2S。
(2)O、S属于同主族元素,其单质的氧化性不同,用一反应的化学方程式表示:_____________,O、S、![]() 半径从大到小的顺序是_________________。
半径从大到小的顺序是_________________。
II.1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应: ![]() 并达到平衡。
并达到平衡。
(1)上述平衡的平衡常数表达式![]() _____________。欲使
_____________。欲使![]() 值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
值变大,可采取的措施是__________________________。平衡后,向容器中充入1mol H2,平衡向__________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)_________判断该反应已经达到平衡状态。若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%, ![]() ________。
________。
【答案】 1S22S22P63S23P6 18 ![]() > 2H2S+O2→2S↓+2H2O S2->S>O
> 2H2S+O2→2S↓+2H2O S2->S>O  升高温度 正反应方向 增大 能 7.2×10-4mol/(L·min)
升高温度 正反应方向 增大 能 7.2×10-4mol/(L·min)
【解析】试题分析:(1)![]() 核外有18个电子;有几个电子就有几种运动状态;Na2O由钠离子和氧离子构成;离子半径越小晶格能越大,熔点越高;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,可以通过氧化剂的氧化性大于氧化产物的氧化性证明;O原子2个电子层,S、
核外有18个电子;有几个电子就有几种运动状态;Na2O由钠离子和氧离子构成;离子半径越小晶格能越大,熔点越高;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,可以通过氧化剂的氧化性大于氧化产物的氧化性证明;O原子2个电子层,S、![]() 都有3个电子层、16个质子,S原子的电子数16、
都有3个电子层、16个质子,S原子的电子数16、![]() 的电子数18;II. (1)固体不能写入平衡常数表达式;增大反应物浓度平衡正向移动;增大氢气浓度,重新达到平衡后
的电子数18;II. (1)固体不能写入平衡常数表达式;增大反应物浓度平衡正向移动;增大氢气浓度,重新达到平衡后![]() 的浓度增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据
的浓度增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据![]() ,反应过程中密度是变量;根据
,反应过程中密度是变量;根据![]() 计算反应速率。
计算反应速率。
解析:(1)![]() 核外有18个电子,根据能量最低原则,核外电子排布式是1S22S22P63S23P6;有几个电子就有几种运动状态,所以核外有18种不同运动状态的电子;Na2O由钠离子和氧离子构成,Na2O的电子式是
核外有18个电子,根据能量最低原则,核外电子排布式是1S22S22P63S23P6;有几个电子就有几种运动状态,所以核外有18种不同运动状态的电子;Na2O由钠离子和氧离子构成,Na2O的电子式是![]() ;离子半径越小晶格能越大,熔点越高,氧离子半径小于硫离子,所以熔点Na2O>Na2S;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,根据氧化剂的氧化性大于氧化产物的氧化性,向硫化氢溶液中通入氧气生成浅黄色沉淀S可以证明氧化性O2>S,化学方程式是
;离子半径越小晶格能越大,熔点越高,氧离子半径小于硫离子,所以熔点Na2O>Na2S;(2)同主族元素从上到下氧化性减弱,所以氧化性O2>S,根据氧化剂的氧化性大于氧化产物的氧化性,向硫化氢溶液中通入氧气生成浅黄色沉淀S可以证明氧化性O2>S,化学方程式是![]() ;O原子2个电子层,S、
;O原子2个电子层,S、![]() 都有3个电子层、16个质子,S的电子数16、
都有3个电子层、16个质子,S的电子数16、![]() 的电子数18,所以O、S、
的电子数18,所以O、S、![]() 半径从大到小的顺序是S2->S>O;II. (1)固体不能写入平衡常数表达式,平衡常数表达式
半径从大到小的顺序是S2->S>O;II. (1)固体不能写入平衡常数表达式,平衡常数表达式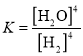 ;该反应吸热,升高温度平衡正向移动,平衡常数增大;增大反应物浓度平衡正向移动,所以平衡后,向容器中充入1mol H2,平衡向正反应方向移动;增大氢气浓度,重新达到平衡后
;该反应吸热,升高温度平衡正向移动,平衡常数增大;增大反应物浓度平衡正向移动,所以平衡后,向容器中充入1mol H2,平衡向正反应方向移动;增大氢气浓度,重新达到平衡后![]() 的浓度增大,所以逆反应速率增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据
的浓度增大,所以逆反应速率增大;(2)根据方程式,反应过程中气体由氢气变为水蒸气,气体质量增大,容器体积不变,根据![]() ,反应过程中密度是变量,所以若混合气体的密度不变,能说明反应达到平衡状态;2.84g Na2SO
,反应过程中密度是变量,所以若混合气体的密度不变,能说明反应达到平衡状态;2.84g Na2SO![]() =
=![]() 7.2×10-4mol/(L·min)。
7.2×10-4mol/(L·min)。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).
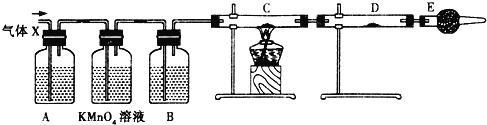
注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g) ![]() pC(g)+qQ(g) 当m、n、p、q为任意整数且C为有色物质,可逆反应一定达到平衡的标志是 ( )
pC(g)+qQ(g) 当m、n、p、q为任意整数且C为有色物质,可逆反应一定达到平衡的标志是 ( )
①混合气体的平均摩尔质量不再改变 ②体系的温度不再改变③各组分的浓度不再改变
④各组分的质量分数不再改变 ⑤反应速率VA:VB:VC:VQ=m:n:p:q ⑥体系颜色不再变化
⑦单位时间内m mol A断键反应,同时p mol C也断键反应
A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑥⑦ D. ①②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。某探兖小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:

(1)仪器a的名称是______________。
(2)装置A中发生反应的离子方程式为____________________________________。
(3)仪器b中冷凝水从______(填“p”或“q”,下同)口进,___________口出。
(4)若撤去装置B,对实验的影响是__________________________________________________。
(5)实验时发现D中导管口处气泡速率过快,合理的解决方法是______________________。
(6)已知:CCl3CHO+OH-→CHCl3+HCOO-;HCOO-+I2-=H++2I-+CO2↑;I2+2S2O32-=2I-+S4O62-。称取0.40g产品,配成待测溶液,加入20.00mL0.100mol·L-1碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol·L-1的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定时所用指示剂是__________________________,达到滴定终点的现象是_____________________________________________________,测得产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强氧化剂XO(OH)2+被Na2SO3还原。如果还原2.4×10-3molXO(OH) 2+,需用30mL0.2mol·L-1的Na2SO3溶液,那么X元素被还原后的价态是( )
A.-1B.0C.+1D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A在酸性溶液中加热可发生如下反应,下列说法错误的是( ) 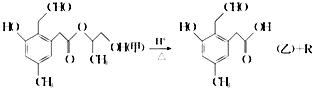
A.R为二元醇,不能发生银镜反应
B.1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2
C.甲在碱性条件下也可发生水解反应
D.甲和乙均能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的环境中一定能大量共存的是 ( )
A. 滴加石蕊试液显红色的溶液:Fe3+、NH![]() 、Cl-、SCN-
、Cl-、SCN-
B. 加入铝粉能产生H2的溶液:NH![]() 、Fe2+、SO
、Fe2+、SO![]() 、NO
、NO![]()
C. 含有大量HCO![]() 的溶液:NH
的溶液:NH![]() 、Ca2+、Mg2+、I-
、Ca2+、Mg2+、I-
D. 含有大量ClO-的溶液:H+、Mg2+、I-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
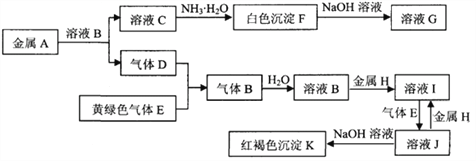
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:___________________________
(5)检验溶液I中阳离子的方法是:__________________________
(6)向30 mL 1 mol·L-1的C溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为______________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com