
 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
分析 由图可知,X的浓度从开始到5min时一直在减少,第5min时,浓度不再发生变化,则该反应达到平衡状态,
A.结合v=$\frac{△c}{△t}$计算;
B.平衡时各物质的浓度不变;
C.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
D.物质的量与反应中热量变化成正比.
解答 解:A.由图可知,2min内,X的浓度变化量为0.9mol/L-0.4mol/L=0.5mol/L,则X的平均反应速率为$\frac{0.5mol/L}{2min}$=0.25mol/(L•min),故A正确;
B.第5min时,X的物质的量浓度不再变化,该反应达到平衡状态,故B正确;
C.第5min后,为平衡状态,Y与X的化学计量数之比为4:1,则Y的生成速率的4倍与X的生成速率相等且保持不变,故C错误;
D.5min内参加反应的X为2L×(0.9mol/L-0.1mol/L)=1.6mol,结合热化学方程式可知1molX反应放热为QkJ,则反应放出的热量为1.6QkJ,故D正确;
故选C.
点评 本题考查物质的量浓度随时间的变化曲线,为高频考点,把握图中物质的量浓度的变化、平衡状态的判断及特征、反应中能量变化等为解答的关键,侧重分析与应用能力的考查,注意图象的分析与应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| B. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| C. | 用溶解、过滤的方法分离K2MnO4和MnO2固体的混合物 | |
| D. | 用分液的方法分离煤油和汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
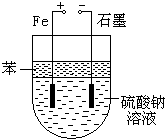 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
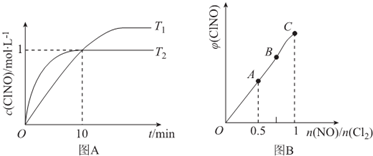
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
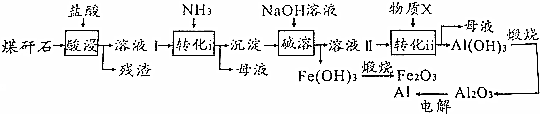
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ | |
| C. | 由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定 | |
| D. | 在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠可用作呼吸面具和潜水艇中做氧气的来源 | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,2二甲基丁烷.
2,2二甲基丁烷.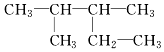 2,3二甲基戊烷.
2,3二甲基戊烷.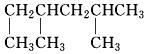 2,4二甲基己烷.
2,4二甲基己烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com