
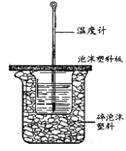
����Ŀ����V1 mL 1.0 mol��L-1 HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ�������¼��Һ���¶ȣ�ʵ��������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50��

��1�����ڷ�Ӧ��HCl+NaOH= NaCl+H2O����Ӧ�������е�������E1�������������е�������E2�Ĺ�ϵΪ��E1____E2��������>������ <������=����
��2��ʵ��������NaOH��Һ��Ũ��Ϊ____mol��L-1��
��3��������8.0 g NaOH��ϡ��Һ���Թ�����1 L 0.21 mol��L-1�����ᷴӦ�ų�11.46 kJ�����������ʾ�к��ȵ��Ȼ�ѧ����ʽΪ___________________��
��4����ȡ50mL0.50mol/L������50mL0.55mol/LNaOH��Һ������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺
����ʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��_________��
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶� ��t2���� | ||
���� | NaOH��Һ | ƽ��ֵ | ||
1 | 25.1 | 24.9 | 25.0 | 28.0 |
2 | 25.1 | 25.1 | 25.1 | 28.2 |
3 | 25.1 | 25.1 | 25.1 | 28.3 |
4 | 25.1 | 25.1 | 25.1 | 27.4 |
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.00g/cm3���кͺ���Һ�ı�����c=4.18kJ/(kg��K)�������ϱ����ݣ�����÷�Ӧ���к�����H=____________ (����2λС��) ��
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ�������_______________��
���𰸡� > 1.5 HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l)����H=-57.3 kJ/mol ���β�������� -51.83 kJ/mol ʵ��װ�ñ��¡�����Ч����ֶ�ε���NaOH��Һ�������Һδ��ֽ����
��������������������⿼���к����Ȼ�ѧ����ʽ����д���к��ȵIJⶨ����������
��1����ӦHCl+NaOH= NaCl+H2O�Ƿ��ȷ�Ӧ����Ӧ�������е�������E1���������������е�������E2��
��2��ͼ�����¶����ʱ���ǡ����ȫ��Ӧ��V1=30mL����V2=50mL-30mL=20mL��n��NaOH��=n��HCl����c��NaOH��![]() 20mL=1.0mol/L
20mL=1.0mol/L![]() 30mL��c��NaOH��=1.5mol/L��
30mL��c��NaOH��=1.5mol/L��
��3��n��NaOH��=8.0g![]() 40g/mol=0.2mol����Ӧ����ˮ�����ʵ���Ϊ0.2mol�����к�����H=-
40g/mol=0.2mol����Ӧ����ˮ�����ʵ���Ϊ0.2mol�����к�����H=-![]() =-57.3kJ/mol���к��ȱ�ʾ���Ȼ�ѧ����ʽΪHCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)����H=-57.3 kJ/mol��
=-57.3kJ/mol���к��ȱ�ʾ���Ȼ�ѧ����ʽΪHCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)����H=-57.3 kJ/mol��
��4������ʵ��װ���Ϲ۲죬ȱ�ٵ�һ�ֲ�����Ʒ�ǻ��β����������
��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ��Ӧ��NaOH���������ɵ�n��H2O��=n��HCl��=0.50mol/L![]() 0.05L=0.025mol��ʵ��1��2��3��4��ֹ�¶�����ʼ�¶ȵIJ�ֵ����Ϊ3.0����3.1����3.2����2.3��������ʵ��4���ϴ�����ʵ��1��2��3����ʵ���¶Ȳ��ƽ��ֵΪ
0.05L=0.025mol��ʵ��1��2��3��4��ֹ�¶�����ʼ�¶ȵIJ�ֵ����Ϊ3.0����3.1����3.2����2.3��������ʵ��4���ϴ�����ʵ��1��2��3����ʵ���¶Ȳ��ƽ��ֵΪ![]() =3.1������Ӧ�����зų�������Q=cm��t=4.18kJ/(kg��K)
=3.1������Ӧ�����зų�������Q=cm��t=4.18kJ/(kg��K) ![]() ��1.00g/cm3
��1.00g/cm3![]() 50mL+1.00g/cm3
50mL+1.00g/cm3![]() 50mL��
50mL��![]() 10-3kg/g
10-3kg/g![]() 3.1K=1.2958kJ������1molH2O�ų�������Ϊ1.2958kJ
3.1K=1.2958kJ������1molH2O�ų�������Ϊ1.2958kJ![]() 0.025mol=51.83kJ/mol���÷�Ӧ���к�����H=-51.83kJ/mol��
0.025mol=51.83kJ/mol���÷�Ӧ���к�����H=-51.83kJ/mol��
��51.83kJ/mol![]() 57.3kJ/mol��˵����õ��к��ȵ�ʵ����ֵƫС��������ʵ�����������ɢʧ���£�����ƫ��Ŀ���ԭ����ʵ��װ�ñ��¡�����Ч����ֶ�ε���NaOH��Һ�������Һδ��ֽ������
57.3kJ/mol��˵����õ��к��ȵ�ʵ����ֵƫС��������ʵ�����������ɢʧ���£�����ƫ��Ŀ���ԭ����ʵ��װ�ñ��¡�����Ч����ֶ�ε���NaOH��Һ�������Һδ��ֽ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ��
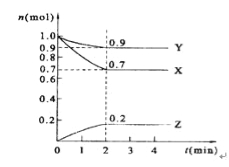
(1)X��ת������
(2)��ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
(3)��Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)= ��
(4)����Ӧ���е��� min���÷�Ӧ�ﵽƽ�⡣���������ʶ������壬ƽ��ʱY��ռ����İٷֱ�Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ����(����)
A. Fe2O3���ڹ����������Һ�У�Fe2O3��6H����2I��===2Fe2����I2��3H2O
B. 0.1 mol��L��1 NH4Al(SO4)2��Һ��0.2 mol��L��1 Ba(OH)2��Һ�������ϣ�Al3����2SO![]() ��2Ba2����4OH��===2BaSO4����AlO
��2Ba2����4OH��===2BaSO4����AlO![]() ��2H2O
��2H2O
C. ��0.1 mol��L��1��pH��1��NaHA��Һ�м���NaOH��Һ��HA����OH��===A2����H2O
D. �����������Һ��ͨ������SO2���壺ClO����SO2��H2O===HClO��HSO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȱ���ͬ���칹�������֣��Ӷ�������֪���ȱ���ͬ���칹����Ŀ�ǣ� ��
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У�����ת������Ҫ��ʽ����ȷ���ǣ� ��
A.��̫���ܵ�ع���ʱ������ת���ɵ���
B.Ǧ���س��ʱ����ѧ��ת���ɵ���
C.�������Һ����ʱ������ת���ɻ�ѧ��
D.ֲ����й������ʱ������ת���ɻ�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᴿ��������Ba(NO3)2���ʵ�KNO3��Һ����ʹ�õķ���Ϊ
A. �������Na2CO3��Һ�����ˣ���ȥ��������Һ�в�������HNO3
B. �������K2SO4��Һ�����ˣ���ȥ��������Һ�в�������HNO3
C. �������Na2SO4��Һ�����ˣ���ȥ��������Һ�в�������HNO3
D. �������K2CO3��Һ�����ˣ���ȥ��������Һ�в�������HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǹ�ҵ��ȡ��þ��MgCO3(������Al2O3��FeCO3)��ȡþ�Ĺ�������

��ش��й����⣺
��1����þ����������ǰ��Ҫ���飬Ŀ���� __________________________��
��2��������ͨ��Cl2��Ŀ�������� _________________________���ѧʽ������ҵ�ϲ�ѡ����������������ԭ����_________________��_________________________��
��3�����ʼ�����_____________
A��MgO B��Mg��OH��2 C��NaOH��Һ D��ϡ��ˮ
��4����MgCl2��Һ��ȡ��ˮMgCl2�IJ������� __________________________��
��5����Fe3+��ȫ����ʱ������СpH__________����֪����������ksp=1.0��10-38������Ũ��С��1��10-5 mol/L��Ϊ������ȫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ 2AB3(g)![]() A2(g) �� 3B2(g) ��H>0������ͼ����ȷ����
A2(g) �� 3B2(g) ��H>0������ͼ����ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ�ũҵ������Ӧ�ù㷺��
��1��������ͼд���ϳɰ����Ȼ�ѧ����ʽ��__________________��

��2����1molN2(g)��3molH2(g)����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������____������ڡ��������ڡ���С�ڡ���92.9KJ��ԭ����_______���������������H______�����������䡱��С������
��3����֪�ֱ��ƻ�1molN��N����1molH-H��ʱ��Ҫ���յ�����Ϊ946KJ��436KJ�����ƻ�1molN-H����Ҫ���յ�����Ϊ___________KJ��
��4����������ʱ��N2H4(g)Ϊȼ�ϡ�NO2Ϊ�����������߷�Ӧ����N2��H2O(g).
��֪N2��g��+2O2��g��=2NO2��g����H1=+67.7kJ/mol��
N2H4��g��+O2��g��=N2��g��+2H2O��g����H2=-534kJ/mol��
д��1mol N2H4��NO2��Ӧ���Ȼ�ѧ����ʽΪ_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com