
【化学——选修3:物质结构与性质】目前半导体生产展开了一场“铜芯片”革命—在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
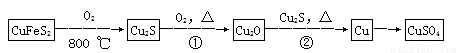
(1)基态铜原子的外围电子排布式为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是___,其立体结构是____。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液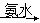 蓝色沉淀
蓝色沉淀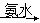 沉淀溶解,得到深
沉淀溶解,得到深
蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式______;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
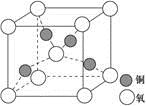
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。
科目:高中化学 来源:2015-2016学年广东仲元中学高二下期末理综化学试卷(解析版) 题型:选择题
现有阳离子交换膜、阴离子交换膜、石墨电极和如图Z9?9所示电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。

下列说法正确的是( )
A.阳极反应式为2H++2e-===H2↑
B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H+通过
D.Na2SO4溶液从E口加入
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中等校高一下期末化学试卷(解析版) 题型:填空题
某反应在体积为5L的恒容密闭的绝热熔器中进行,在0~3分钟内各物质的量的变化情况如图所示(已知A、B、C均为气体)。
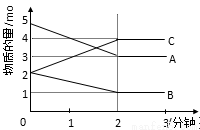
(1)该反应的化学方程式为____________________________________。
(2)反应开始至2分钟时,B的平均反应速率为__________________。
(3)能说明该反应已达到平衡状态的是
A.V(A)=2V(B) B.容器内气体密度不变
C.V逆(A)=V正(C) D.容器内温度不变
(4)由图求得平衡时A的转化率为_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中等校高一下期末化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数。下列说法正确的是
A.标准状况下,7.8g苯中含有的碳碳双键数是0.3NA
B.标准状况下,11.2L四氯甲烷所含分子数为0.5NA
C.常温常压下,14g乙烯分子中含有的碳碳键数目为2NA
D.1mol甲基(-CH3)所含电子数为9NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中等校高一下期末化学试卷(解析版) 题型:选择题
糖类、油脂、蛋白质是维持人体生命活动所必需的营养物质,下列叙述正确的是
A.糖类、油脂、蛋白质都能够发生水解
B.糖类、油脂、蛋白质都是高分子化合物
C.单糖和双糖都能与新制Cu(OH)2 悬浊液反应产生砖红色沉淀
D.蛋白质在浓硝酸作用下能发生颜色反应,可用来鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:选择题
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是( )
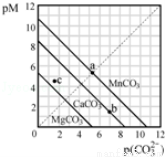
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a 点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32﹣)
C. b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D. c 点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:选择题
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M === NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH-==6 Ni(OH)2 + NO2-
下列说法正确的是( )
A.充电过程中OH- 离子从阳极向阴极迁移
B.充电过程中阴极的电极反应式:H2O + M + e-=MH + OH-,H2O中的H被M还原
C. 电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省松原市高一下期末化学试卷(解析版) 题型:推断题
下表为元素周期表的一部分。
碳 | Y | Z |
|
X |
| 硫 | W |
回答下列问题
(1)W元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省松原市高二下期末化学试卷(解析版) 题型:选择题
某溶液中大量存在5种离子:NO3﹣、SO42﹣、Fe3+、H+、M其物质的量之比为n(NO3﹣):n(SO42﹣):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )
)
A.Fe2+ B.Mg2+ C. Cl﹣ D.Ba2+
Cl﹣ D.Ba2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com