
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) ===2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) △H4=____________________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
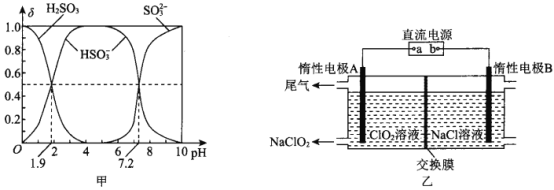
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备 NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)
②阳极的电极反应式为________________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)

(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图(I)所示:
①图(I)中三组实验从反应开始至达到平衡时,v(CO)最大的为___________(填序号)
②与实验a相比,c组改变的实验条件可能是_________________。
【答案】(△H1+2△H2+△H3)/2 由图中数据可以计算出Ka2(H2SO3)=10-7.2 ,Ka1(H2SO3) =10-1.9,所以HSO3—的水解常数是10-12.1,HSO3—电离程度大于水解程度,溶液显酸性 阳离子交换膜 2Cl—--2e-=Cl2↑ 0.03mol·L-1·min-1 11.25 b 升高温度
【解析】
(1)利用盖斯定律同向相加,异向相减的原则计算;
(2)根据图像计算亚硫酸氢根离子的电离常数和水解常数,进行比较确定酸碱性;
(3)仔细分析图像中的反应物和产物即可确定离子交换膜和电极反应式;
(4)利用三行式法进行计算;
(5)通过起点和斜率即可判断;
(1)利用盖斯定律同向相加,异向相减的原则计算△H4=(△H1+2△H2+△H3)/2;
正确答案:(△H1+2△H2+△H3)/2。
(2)根据图像PH=1.9的交点计算水解常数Ka1(H2SO3)=![]() =10-1.9,Kh=Kw/ Ka1(H2SO3)= 10-12.1,根据PH=7.2的交点计算Ka2=
=10-1.9,Kh=Kw/ Ka1(H2SO3)= 10-12.1,根据PH=7.2的交点计算Ka2=![]() =C(H+)=10-7.2 ,由于Kh<Ka2,所以亚硫酸氢根离子电离程度大于水解程度,NaHSO3的水溶液pH<7。
=C(H+)=10-7.2 ,由于Kh<Ka2,所以亚硫酸氢根离子电离程度大于水解程度,NaHSO3的水溶液pH<7。
正确答案:由图中数据可以计算出Ka2(H2SO3)=10-7.2 ,Ka1(H2SO3) =10-1.9,所以HSO3—的水解常数是10-12.1,HSO3—电离程度大于水解程度,溶液显酸性。
(3)仔细分析图像中的反应物和产物,可以看出左侧由ClO2制备NaClO2,需要Na+从右侧到左侧,所以判定为阳离子交换膜,根据Na+的移动方向可知左侧为阴极,右侧为阳极,写出阳极电极反应式2Cl—-2e-=Cl2↑;
正确答案:阳离子交换膜 2Cl—-2e-=Cl2↑。
(4) 2CO(g)+ SO2(g) ![]() S(l)+2CO2(g) ΔH=-270kJ/mol
S(l)+2CO2(g) ΔH=-270kJ/mol
C(初) 1 0.5 0
△C x x/2 x
C(平) 1-x 0.5(1-x) x
根据题干可知0.5=![]() ,计算得出x=0.6
,计算得出x=0.6
v(CO)=![]() =
=![]() =0.03mol·L-1·min-1,k=
=0.03mol·L-1·min-1,k=![]() =
=![]() =11.25;
=11.25;
正确答案:0.03mol·L-1·min-1 11.25。
(5)①根据斜率可以看出b线单位时间内变化最快,所以图(I)中三组实验从反应开始至达到平衡时,v(CO)最大的为b;
②根据PV=nRT,可知n,V相同时,压强越大,温度越高,所以与实验a相比,c组改变的实验条件可能是升高温度;
正确答案:①b;②升高温度。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
A. 加催化剂v正、v逆都发生变化,而且变化的倍数相等
B. 加压v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数
D. 加入氩气,v正、v逆都增大且v正增大的倍数大于v逆增大的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过如下反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________(用K1和K2表示)。
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl—N===O):
化学键 | N≡O | Cl—Cl | Cl—N | N===O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
(3)按投料比2∶1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图(a)所示:
①该反应的ΔH________(填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。


(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),在n(NO)/n(Cl2)=1.5时达到平衡状态,ClNO的体积分数可能是图(b)中D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
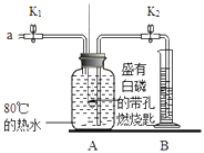
(实验)
①检查装置的气密性,气密性良好。
②向A瓶中加满80℃热水,将盛有白磷的带孔燃烧匙快速浸没热水中,塞紧瓶塞,白磷不燃烧。
③打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。
(1)对比步骤②和③的现象可知,可燃物燃烧的条件之一是___;白磷燃烧的反应方程式为_____。
(2)待装置冷却一段时间后,打开K2,如果观察到____,说明空气中氧气的体积约占1/5。如何确定此装置气密性良好?(忽略燃烧匙位置漏气情况)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液(废液中杂质沉淀后进入滤液中)的工艺流程如下:
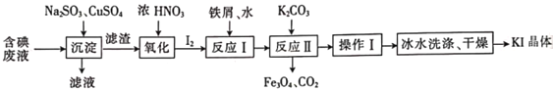
(1)“沉淀”后滤渣为______________________(填化学式,其中滤渣中Cu元素为+1价)
(2)“氧化”反应的离子方程式为______________________。
(3)反应I中只生成化合物FexIy(其中I与Fe的质量比为127︰21),反应中铁屑是___________(填“氧化剂”“还原剂”或“催化剂”,下同),水是___________。反应消耗的铁与转移电子的物质的量之比为___________。
(4)反应Ⅱ的化学方程式为_________________________________。
(5)操作I除蒸发皿、酒精灯外还需用到的玻璃仪器有______________________。冰水洗涤的目的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
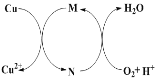
下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com