
【题目】标准状况下,体积相同的下列四组物质,分子数相同的一组是( )
A.Cl2、CO
B.CO、CCl4
C.CO、C
D.H2O、CO2
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 纳米材料是指一种称为“纳米”的新物质制成的材料
B. 复合材料有强度高、质量轻、耐高温、耐腐蚀等性能,其综合性质超过单一材料
C. 光导纤维是以二氧化硅为主要原料制成的
D. 合成纤维的主要原料是石油、天然气、煤等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是制造光电池的一种原料,人体缺少硒就会得“克山病”。从电解精炼铜的阳极泥中提取硒的流程如下,已知阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在:

请回答下列问题:
(1)电解精炼铜时,粗铜与电源的_____(填“正极”或“负极”)相连。
(2)SeO2溶于水得到H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),常温下亚硒酸溶液与少量氢氧化钠溶液反应的离子方程式为:_________________,反应所得的盐形成的溶液pH____7,(填>、<或=)原因是________________________________(用相关数据及必要的文字说明)
(3)亚硒酸溶液与SO2反应制硒的化学方程式为_____________________________。电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阴极反应式为________________。
(4)上述硒的提取过程中除了焙烧过程中浓硫酸有强烈的腐蚀性外,还存在的主要问题是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将苯加入溴水中振荡后,水层接近无色,是因为发生了取代反应
B. 2,2-二甲基丙烷也称新戊烷
C. 等质量的乙烯和乙醇在氧气中充分燃烧耗氧量相同
D. 环己醇能与氢氧化钠溶液反应且所有碳原子可以共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
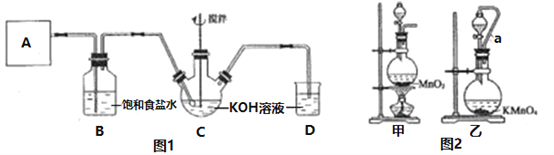
回答下列问题:
(1)装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是________,若选用装置乙,其中的导管a的作用是________。
(2)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是________;在通入氯气的过程中,不断搅拌的目的是_____________。
(3)制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为______,反应的离子方程式是____________。
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3mol/LKOH溶液中________(填操作名称),将滤液置于冰水浴中,再加入______,搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
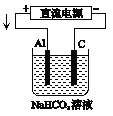
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com