
【题目】图1是元素周期表的一部分.表中所列的字母分别代表一种化学元素. 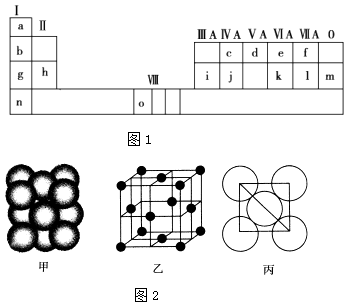
试回答下列问题:
(1)请写出元素o的基态原子外围电子排布式 .
(2)d的氢化物的分子构型为 , 中心原子的杂化形式为;k在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(填“极性”或“非极性”)分子.
(3)i单质晶体中原子的堆积方式如图2甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示. 若已知i的原子半径为d cm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为 , 一个晶胞中i原子的数目为 .
②该晶体的密度为(用字母表示).
【答案】
(1)1s22s22p63s23p63d64s2
(2)三角锥形;sp3;V型;sp2;极性
(3)12;4;![]() ?g/cm3
?g/cm3
【解析】解:(1)由元素在周期表中的位置可知,元素o处于第四周期第Ⅷ族,为26号元素Fe,原子核外有26个电子,根据构造原理其核外电子排布式为:1s22s22p63s23p63d64s2 , 所以答案是:1s22s22p63s23p63d64s2;(2)d为N,其氢化氢为NH3 , N原子有1对孤对电子,成键数为3,N原子为sp3杂化,为三角锥形;k为S元素,在空气中燃烧生成SO2 , S有1对孤对电子,存在S=O键,S原子采取sp2杂化,V型,正负电荷中心不重合,为极性分子,
所以答案是:三角锥形;sp3;V型;sp2;极性;(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;晶胞中含有原子数目=8× ![]() +6×
+6× ![]() =4,
=4,
所以答案是:12;4;②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为, ![]() ×4dcm=2
×4dcm=2 ![]() d cm,晶胞体积为(2
d cm,晶胞体积为(2 ![]() dcm)3=16
dcm)3=16 ![]() d3cm3 , 晶胞中含有原子数目=8×
d3cm3 , 晶胞中含有原子数目=8× ![]() +6×
+6× ![]() =4,
=4,
相对原子质量为M,故晶胞的质量=4× ![]() g,故晶体的密度=
g,故晶体的密度= 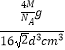 g/cm3=
g/cm3= ![]() g/cm3 ,
g/cm3 ,
所以答案是: ![]() g/cm3 .
g/cm3 .


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列关于氢氧化铁胶体的叙述中,正确的是( )
A. 制备氢氧化铁胶体的化学方程式是FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
B. 在制备氢氧化铁胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C. 用平行光照射氯化钠溶液和氢氧化铁胶体时,产生的现象相同
D. 氢氧化铁胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
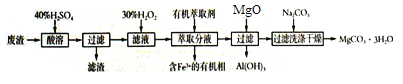
(1)酸溶时废渣中主要成分发生反应的离子方程式为_________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+,萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂______________________________。
(4)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
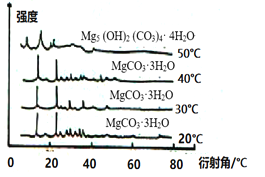
(5)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为_______________,温度较高时MgCO3·3H2O发生转化的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有K+、Mg2+、SO42-、NO3-四种离子,已知其中Mg2+、K+、NO3-三种离子的个数比为4:5:3,则SO42-与NO3-离子的个数之比为
A.2:1B.1:1C.5:3D.10:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是 , , , , 同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a . 曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b 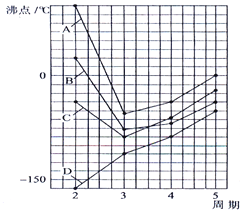
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列八种物质:①丙烯、②甲苯、③聚氯乙烯、④聚异戊二烯、⑤丙炔、⑥环己烷、⑦环己烯、⑧溴乙烷中既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
A.①③④⑤⑦
B.④⑤⑦
C.④⑤
D.①④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.![]() 与
与 ![]() 得电子能力相同
得电子能力相同
B.核外电子排布相同的微粒化学性质也相同
C.Cl﹣、S2﹣、Ca2+、K+半径逐渐减小
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的 18 种元素具有重要的用途.
(1)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价 电子排布式为 , 第四周期元素的第一电离能随原子序 数的增大,总趋势是逐渐增大的,但 Ga 的第一电离能却明显低于 Zn,原因是 .
(2)已知四溴化锗是电子工业中的一种常用试剂,其熔点为 26.1℃,沸点为 186℃,则 GeBr4 的晶体类型为 , 中心原子的杂化类型为 , 与 SiBr4 相比,沸点较低的物质是 .
(3)第四周期ⅤA~ⅦA 族的元素中,电负性由大到小的顺序为(用元素符号表 示) .
(4)如图 1 所示为二维平面晶体示意图,所表示的化学式为 AX3 的是;图 2 为一个金属铜的晶胞,此晶胞立方体的边长为 a cm,金属铜的 密度为 ρ g/cm3 , 则阿伏伽德罗常数可表示为(用含 a、ρ 的代数式表示).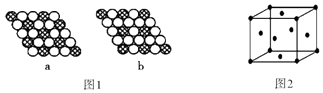
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com