
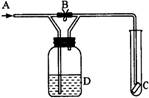
如右图是一种试验某气体化学性质的实验装置,图中B为止水夹。如先打开B,在A处通入干燥氯气,C中红布条颜色无变化;当关闭B时,C中红布条颜色褪去。则D瓶中盛有的溶液是( )。
A.浓硫酸 B.浓NaOH溶液 C.四氯化碳 D.饱和NaCl溶液
科目:高中化学 来源: 题型:
由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
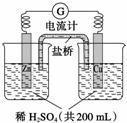
(1)原电池的负极反应式是_________________________________________________,
(2)电流的方向是_________________________________________________________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗________g锌
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应:2SO2 (g)+O2(g)  2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强
B.升高温度
C.使用催化剂
D.多充入O2
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L—1 H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。已知:金属离子氢氧化物沉淀所需pH是
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3. 3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A.MgO B.Na2CO3 C.蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如图所示。
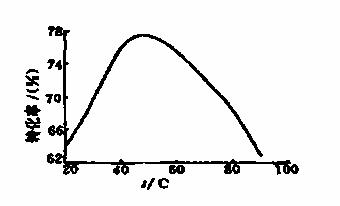
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
制取漂白液的化学方程式是:Cl2+2NaOH==NaCl+NaClO+H2O,该反应的氧化剂与还原剂的物质的量之比为( )。
A.1∶1 B.1∶2 C.2∶1 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中的MnO2和浓盐酸共热制Cl2,反应如下:MnO2+4HCl (浓) NaCl2+2H2O+Cl2↑用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到氯气的物质的量是( )
NaCl2+2H2O+Cl2↑用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到氯气的物质的量是( )
A.等于2 mol B.等于1 mol C.小于1 mol D.大于2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有较大量的Cl-、CO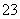 、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
a mol N2与a mol CO相比较,下列叙述中不正确的是( )
A、质量一定相同 B、所含分子数一定相同 C、所含原子数一定相同 D、气体体积一定相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com