
| A. | 能溶于水的盐是强电解质,不溶于水的盐是非电解质 | |
| B. | 强电解质溶液中不存在分子,弱电解质溶液中必存在溶质分子 | |
| C. | 在熔融状态下能导电的化合物一定是离子化合物,也一定是强电解质 | |
| D. | 强电解质一定能导电,非电解质的水溶液一定不导电 |
分析 A、强弱电解质的本质区别在于电离程度;
B、强电解质溶液中不存在溶质分子;
C、离子键在熔融状态下能被破坏,共价键在熔融状态下不能被破坏;
D、强电解质本身不一定能导电.
解答 解:A、强弱电解质的本质区别在于电离程度,与水溶性无关,即强电解质不一定能溶于水,弱电解质不一定不溶于水,故A错误;
B、强电解质溶液中不存在溶质分子,但存在水分子,故B错误;
C、离子键在熔融状态下能被完全破坏,共价键在熔融状态下不能被破坏,故在熔融状态下能导电的一定是离子化合物,而离子键在熔融状态下能完全破坏,故能完全电离,故为强电解质,故C正确;
D、强电解质本身不一定能导电,如氯化钠固体,是强电解质,但不能导电;非电解质的水溶液可以导电,如二氧化碳的水溶液能导电,故D错误.
故选C.
点评 本题考查了强弱电解质的本质区别,应注意的是强弱电解质与溶解度的大小、离子浓度大小、溶液的导电能力无关,只取决于能否完全电离.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S原子核内的中子数为16 | B. | 13C和15N原子核内的质子数相差2 | ||
| C. | 16O与18O的核电荷数相等 | D. | 2H+质量与1H+的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
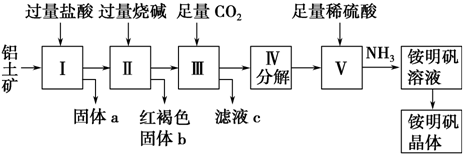
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| B. | 在pH=12的溶液中:ClO-、SO32-、Na+、K+ | |
| C. | 能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO-、I- | |
| D. | 澄清透明的溶液中:Cu2+、Fe3+、NO3?、Cl ? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化亚铁溶液中通入过量氯气.2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| B. | 草酸和少量烧碱溶液:H2C2O4+OH-═HC2O4-+H2O | |
| C. | 漂白粉溶液吸收过量的二氧化碳:ClO-十H2O+CO2═HClO+HCO3- | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全NH4++H++SO42-+Ba2++2OH-═NH3•H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | C | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | HCl | H2O |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com