

分析 一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,溶解Ni反应有N2生成,过滤除去废渣,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠调节溶液PH除去铁离子,过滤得到滤渣和滤液,滤液中加入H2S沉淀铜离子,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入氢氧化钠溶液沉淀镍离子生成氢氧化镍固体,
(1)镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平书写离子方程式;
(2)过氧化氢氧化亚铁离子为铁离子便于除去且不沉淀其他金属离子,利用铁氰化钾和亚铁离子结合生成蓝色溶液检验亚铁离子是否除净;由题给信息,黄钠铁矾[NaxFey(SO4)m(OH)n]元素化合价代数和为0;
(3)硫化氢和铜离子反应生成难溶于酸的硫化铜沉淀,硫化氢是剧毒气体分析;
(4)NaF的实际用量为理论用量的1.1倍,用量不宜过大是因为,过量氟化钠会在溶液中生成氟化氢,陶瓷容器中的二氧化硅会和氟化氢形成的酸溶液反应;
(5)废料含镍质量分数约21%,100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,依据镍元素守恒计算回收得到镍和原来镍的质量,计算回收率;
(6)正极上NiOOH得电子生成Ni(OH)2.
解答 解:一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,溶解Ni反应有N2生成,过滤除去废渣,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠调节溶液PH除去铁离子,过滤得到滤渣和滤液,滤液中加入H2S沉淀铜离子,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入氢氧化钠溶液沉淀镍离子生成氢氧化镍固体,
(1)镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平书写离子方程式为:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O,
故答案为:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O;
(2)“除铁”时H2O2的作用是过氧化氢氧化亚铁离子为铁离子便于除去且不沉淀其他金属离子,为了证明添加的H2O2已足量,应选择的试剂是利用铁氰化钾和亚铁离子结合生成蓝色溶液检验亚铁离子是否除净,由题给信息,将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去,黄钠铁矾[NaxFey(SO4)m(OH)n]中铁元素化合价为+3价,元素化合价代数和为0,x+3y-2m-n=0,得到x+3y=2m+n,x:y:m:n=1:3:2:p,则p=6,
故答案为:将亚铁离子氧化为铁离子;铁氰化钾;6;
(3)硫化氢和铜离子反应生成难溶于酸的硫化铜沉淀,反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,硫化氢是剧毒气体,若用Na2S或Na2S2O3代替H2S除铜,优点是无易挥发的有毒气体硫化氢污染环境,
故答案为:H2S+Cu2+=CuS↓+2H+,无易挥发的有毒气体硫化氢污染环境;
(4)NaF的实际用量为理论用量的1.1倍,用量不宜过大是因为,过量氟化钠会在溶液中生成氟化氢,陶瓷容器中的二氧化硅会和氟化氢形成的酸溶液反应,
生成氢氟酸会腐蚀陶瓷容器,
故答案为:过量的F-离子生成氢氟酸会腐蚀陶瓷容器;
(5)废料含镍质量分数约21%,100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,废料中镍元素质量=100kg×21%=21kg,反应生成镍元素质量=$\frac{31}{93}$×59kg,则镍回收率的计算式=$\frac{\frac{31}{93}×59}{21}$×100%=$\frac{31×59}{93×21}$×100%,
故答案为:$\frac{31×59}{93×21}$×100%;
(6)NiMH电池放电过程中,正极上NiOOH得电子生成Ni(OH)2,则正极的电极方程式为:NiOOH+H2O+e-=Ni(OH)2+OH-,
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-.
点评 本题考查了物质分离的实验设计和方法应用、元素守恒的有关计算、原电池原理和电极反应书写,主要是利用溶液不同PH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,同时考查了除杂原则不能引入新的杂质,硫、铁及其化合物性质分析判断,题目难度中等.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- |
| A. | 在pH<4的溶液中,碳钢主要发生析氢腐蚀 | |
| B. | 在pH>6的溶液中,碳钢主要发生吸氧腐蚀 | |
| C. | 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-═2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
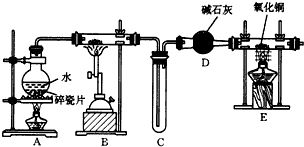
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
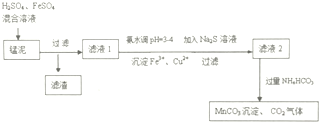
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
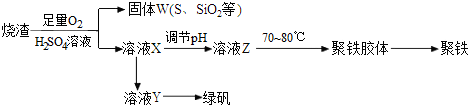

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 时间 (s) 浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为零 | |
| D. | 化学反应中,纯液体物质不能计算其速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com