
【题目】将铁放入下列溶液中,溶液的质量会减少的是
A. 盐酸溶液 B. 硫酸锌溶液 C. 硫酸铁溶液 D. 硫酸铜溶液
科目:高中化学 来源: 题型:
【题目】有反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
(1)在恒温恒压条件下进行,反应正向进行的是________;反应逆向进行的是________;处于平衡状态的是________;无法判断是否达到平衡的是________。
A.单位时间内生成1mol N2,同时生成3mol NH3
B.单位时间内生成3mol N2,同时生成6mol N—H键
C.混合气体的密度不再随时间而改变
D.容器中气体的压强不再随时间而改变
(2)在一定温度下某恒容密闭容器中,充入3molH2和1mol的N2,2min达到平衡状态时,总的气体的物质的量变为原来的9/10,则此时N2的转化率为__________;
若此时放出的热量为18.44 kJ,则其热化学方程式为______________________________ .
根据所求出的热化学方程式,且已知1mol氮氮三键断裂需要为945.8kJ的能量,1mol氢氢键断裂需要436 kJ的能量,求1molN-H键断裂吸收的能量_____。
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,
则氨燃料电池的负极电极反应为________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
A.用排水法收集铜粉与浓硝酸反应产生的NO2
B.用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C.用酸性KMnO4溶液验证草酸的还原性
D.用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用,下列说法不正确的是
A.氧化铝用作耐火材料
B.Na2O常用于潜水艇或呼吸面具的供氧剂
C.硅酸钠是制备木材防火剂的原料
D.FeCl3溶液可用于刻制印刷铜电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,中国科学家屠哟哟因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。青蒿素结构简式如图所示。己知一个碳原子上连有4个不同的原子或基团,该碳原子称了“手性碳原子”。下列有关青蒿素的说法不正确的是( )
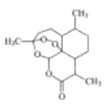
A. 青蒿素分子有6个手性碳原子
B. 青蒿素的化学式为:C15H22O5
C. 青蒿素在一定条件下能与NaOH溶液反应,且有氧化性
D. 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指
A. 乙烯B. 脱落酸C. 生长素D. 甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质的分类正确的是( )
A.水玻璃属于纯净物
B.SiO2、烧碱、明矾分别为酸性氧化物、碱、盐
C.Cu、NaCl、HCl、氯水均为电解质
D.CaO、Na2O、Na2O2均属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含1molO2的空气(不考虑其他酸性气体)充入2L的恒容密闭容器中,某温度时,在催化剂作用下发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H<0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体减少了1.8 mol。再将剩余气体通过某溶液吸收O2,气体又减少了0.2 mol。请回答下列问题:
2SO3 (g) △H<0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体减少了1.8 mol。再将剩余气体通过某溶液吸收O2,气体又减少了0.2 mol。请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母)。
a.容器中混合气体的密度保持不变 b.SO2体积分数保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)欲提高SO2的转化率,下列措施可行的是_______(填字母)。
a.向容器中再充人N2 b.向容器中再充入O2
c.改变反应的催化剂 d.降低温度
(3)升高温度,上述反应的平衡常数K______(填“增大”“减小”或“不变”,下同),化学反应速率______。
(4)该温度下,反应2SO2 (g) +O2 (g) ![]() 2SO3(g)的平衡常数K=___________。
2SO3(g)的平衡常数K=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com