
| A. | 在同温同压下,相同体积的任何气体所含的原子数相同 | |
| B. | 相同条件下,N2和O2的混合气体与等体积的N2所含原子数相等 | |
| C. | 等物质的量的NH4+和OH-所含质子数相等且电子数也相等 | |
| D. | 1mol 乙基中含有的电子数为18NA |
分析 A.气体分子中原子个数不等,有单原子分子、双原子分子、三原子分子等;
B.从N2和O2的分子组成分析,两者都为双原子分子;
C.阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数;
D.依据取代基的结构计算电子数.
解答 解:A.在同温同压下,相同体积的任何气体所含分子数相同,但原子数不一定相同,如硫化氢为三原子分子,氯化氢为双原子分子,故A错误;
B.相同条件下,N2和O2的混合气体与等体积的N2的物质的量相同,则分子数相同,N2和O2的分子组成原子数目相同,则所含原子数相等,故B正确;
C.一个OH-具有9个质子,10个电子;一个NH4+中有11个质子和10个电子,所以等物质的量的NH4+和OH-所含的质子数不同,故C错误;
D.1mol乙基-CH2CH3的结构简式计算,含有的电子数=(6+2+6+3)NA=17NA,故D错误;
故选B.
点评 本题考查阿伏加德罗定律及推论的应用、微粒数目的计算,题目难度中等,注意把握粒子的组成原子的结构特点,明确阴阳离子中电子数和质子数的关系.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
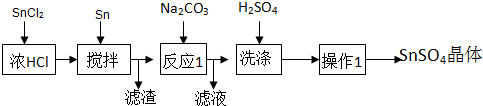
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
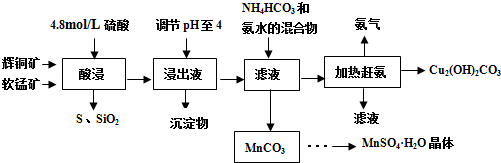
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质物质的量浓度大于9.2mol/L | B. | 溶液体积为20mL | ||
| C. | 溶质质量分数为49% | D. | 溶质质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
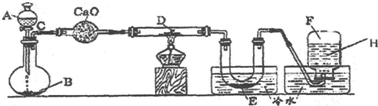
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com