
| A. | 只有①② | B. | 只有①③ | C. | 只有①②③ |
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
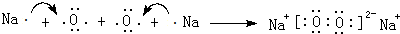 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=11的NaOH和pH=11的KCN溶液中,水的电离程度相等 | |
| B. | 常温下,往Fe(OH)3悬浊液中分别加入少量NaClO、NH4Cl溶液,的溶解度都增大 | |
| C. | NH4Fe(SO4)2溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | |
| D. | 10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合后:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中阴阳离子的个数比都是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
| 空 | 空 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2═2H2O+O2↑ | B. | HCl+NaOH═H2O+NaCl | ||
| C. | Fe+CuCl2═FeCl2+Cu | D. | 2Cu+O2═2CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com