
【题目】一支25mL滴定管,内盛溶液液面在15.00mL刻度处,当将滴定管内液体全部排出时,所得液体的体积是
A. 10.00mL B. 15.00mL C. 小于10.00mL D. 大于10.00mL
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A.a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
B.该装置工作时,H+从a极区向b极区迁移
C.每生成1molO2,有44gCO2被还原
D.该装置将化学能转化为光能和电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种钠盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是
A. HX、HZ、HY B. HZ、HY、HX
C. HX、HY、HZ D. HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧燃料电池具有很大的发展潜力,其工作原理如图所示。下列有关该电池的说法错误的是
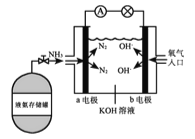
A.该电池工作时,溶液的pH不变
B.a电极为负极,b电极为正极
C.电子从a电极流出,经过导线到达b电极
D.电池总反应为4NH3+3O2=2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.60 g铁投入100 mL某浓度的盐酸中,铁和盐酸恰好完全反应。
求:(1)5.60 g铁的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】很多鲜花和水果的香味都来自酯的混合物。下图是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去)。

请回答下列问题:
(1)B的结构简式为 。
(2)乙烯与水反应生成A的反应类型为 。
(3)A与C反应生成乙酸乙酯的化学方程式为 ,其反应类型为 。
(4)实验室可用右图装置制取乙酸乙酯。
①在试管a中加好相关试剂后,还需要加入2—3块的碎瓷片,其作用是 。
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的 (填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是 。试管b中的导管口应在液面上方而不伸入到液面以下,其原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是( )
A. KAl(SO4)2 12H2O能水解生成Al(OH)3胶体,可用作净水剂
B. SO2有漂白、杀菌性能,可在食品加工中大量使用
C. MnO2有较强的氧化性,可作H2O2分解的氧化剂
D. Si是半导体材料,可用于制光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50 mL 0.1 mol·L-1的NaCl溶液和50 mL 0.5 mol·L-1的CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为
A.2 mol·L-1 B.1 mol·L-1
C.0.67 mol·L-1 D.0.55 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14. 5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0. l000mol.L-1的标准Na2S2O3溶液滴定,消耗标准液50. 00mL,则软锰矿中MnO2含量_________。(己知:2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4;I2+2 S2O32-=2I-+ S4O62-)
II.研宄人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图l所示.

请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2 (SO4)3等,试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+___________=________+_________+CuSO4+MnSO4.
(3)反应II加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为_____________。
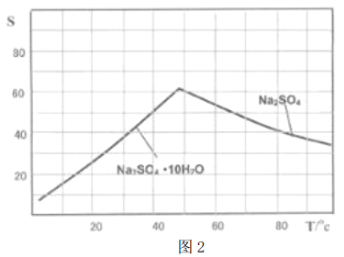
(4)图2是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/l00g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___________→用乙醇洗涤→干燥,用乙醇洗涤而不用水洗的原因是__________________________。
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是_______________________。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有___________(写化学式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com