
| A. | c(Cl-)=c(CH3COO-)的盐酸和醋酸溶液 | |
| B. | 水的电离程度相同的稀硫酸和盐酸 | |
| C. | 水的电离程度相同的氯化按溶液和硫酸铜溶液 | |
| D. | 铵根离子浓度相同的硫酸铵和硫酸氢铵溶液 |
分析 A.这两种酸中分别存在c(H+)=c(OH-)+c(Cl-)、c(H+)=c(OH-)+c(CH3COO-);
B.酸或碱抑制水电离;
C.含有弱离子的盐促进水电离;
D.硫酸铵中铵根离子个数是2、硫酸氢铵中铵根离子个数是1,要使两种溶液中铵根离子浓度,则硫酸铵浓度远远小于硫酸氢铵浓度,硫酸铵是盐、硫酸氢铵是强酸酸式盐,其溶液的pH小.
解答 解:A.这两种酸中分别存在c(H+)=c(OH-)+c(Cl-)、c(H+)=c(OH-)+c(CH3COO-),两种溶液中c(Cl-)=c(CH3COO-),因为都是酸溶液,c(H+)约等于酸根离子浓度,所以两种溶液中c(H+)相等,pH相同,故A不选;
B.酸或碱抑制水电离,稀硫酸和盐酸都抑制水电离,两种溶液中水电离程度相同,说明c(H+)相同,溶液的pH相同,故B不选;
C.含有弱离子的盐促进水电离,硫酸铜和氯化铵都促进水电离,水的电离程度相同,说明溶液中c(H+)相同,pH相同,故C不选;
D.硫酸铵中铵根离子个数是2、硫酸氢铵中铵根离子个数是1,要使两种溶液中铵根离子浓度,则硫酸铵浓度远远小于硫酸氢铵浓度,硫酸铵是盐、硫酸氢铵是强酸酸式盐,相当于强酸性溶液,则溶液的pH硫酸铵大于硫酸氢铵,故D选;
故选D.
点评 本题考查pH有关计算,侧重考查学生分析判断能力,明确水电离影响因素及盐类水解特点是解本题关键,注意电荷守恒的应用,易错选项是D.


科目:高中化学 来源: 题型:多选题
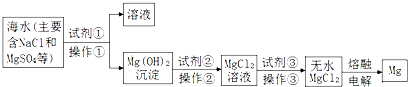
| A. | 试剂①可以选用的试剂是熟石灰,操作①的方法是过滤 | |
| B. | 试剂②可以选用的试剂是盐酸 | |
| C. | 操作③是直接将MgCl2溶液加热蒸发得到无水MgCl2晶体 | |
| D. | 无水MgCl2在通电时发生电离,电解后得到单质Mg. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
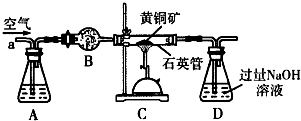

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
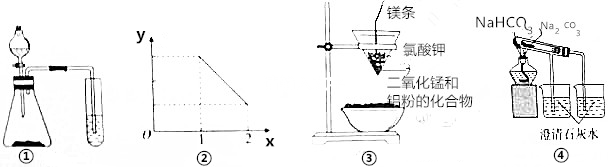
| A. | 用图①装置可比较硫酸、碳酸、硅酸三者的酸性强弱 | |
| B. | 图②表示NO2溶于水完全转化为HNO3时,水(x)与消耗氧气的物质的量(y)之间 关系 | |
| C. | 图③装置可制得金属锰 | |
| D. | 图④装置可验证NaHCO3和NaCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | |
| B. | 反应后溶液中的Cl-数目为(bc•NA-2d) | |
| C. | NA可表示为$\frac{87d}{2a}$ | |
| D. | 反应后溶液中的H+数目为(bc-2d) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业中,将NH3及时液化分离有利于提高产率 | |
| B. | 工业上通常使用电解法制备金属钠、镁、铝、铁等 | |
| C. | 硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 | |
| D. | 电解精炼铜时,将粗铜与电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com