
��O2��HClת��ΪCl2�������Ч�棬������Ⱦ��
��1����ͳ�ϸ�ת��ͨ������ͼ��ʾ�Ĵ���ѭ��ʵ�֣�

���У���Ӧ��Ϊ��2HCl(g) + CuO(s)  H2O(g)+CuCl2(g) ��H1
H2O(g)+CuCl2(g) ��H1
��Ӧ������1molCl2 (g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽ
(g)�ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽ
Ϊ , (��Ӧ���á�H1�͡�H2��ʾ)��
��2������RuO2����������HClת��ΪCl2���ܷ�Ӧ���и��õĴ����ԣ�
��ʵ������һ��ѹǿ�£��ܷ�Ӧ��HClƽ��ת�������¶ȱ仯�Ĩ�HCl��T������ͼ12��
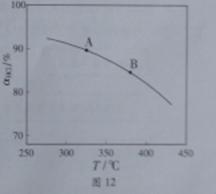
���ܷ�Ӧ�ġ�H 0 ,�����������������������A��B�����ƽ�ⳣ��K(A)��K(B)�нϴ���� ��
��������ʵ������ѹ�����ʹѹǿ��������Ӧ��HCl��T���ߵ�ʾ��ͼ������Ҫ˵�����ɣ� ��
�����д�ʩ����������ߨ�HCl���� ��
 A������n(HCl) B������n(O2)
A������n(HCl) B������n(O2)
C�� ʹ�ø��õĴ��� D����ȥH2O
ʹ�ø��õĴ��� D����ȥH2O
��3��һ�������²�÷�Ӧ������n(Cl 2)���������£�
2)���������£�
����2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ���ʣ���mol��min-1Ϊ��λ��д��������̣���
��4��Cl2��; �㷺��д����Cl2�Ʊ�Ư�۵Ļ�ѧ����ʽ��
�㷺��д����Cl2�Ʊ�Ư�۵Ļ�ѧ����ʽ��
 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ƽ�����ʢ��ǿ��ԭ��Һ̬��(N2H4)��ǿ������Һ̬˫��ˮ�������ǻ�Ϸ�Ӧʱ������������������ˮ���������ų������ȡ���֪��0.4 molҺ̬����������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.652 kJ��������
��1���÷�Ӧ���Ȼ�ѧ����ʽΪ____________________________________________��
��2����֪H2O(l)===H2O(g)����H����44 kJ��mol��1����16 gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������________kJ��
��3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ��������������һ���ܴ���ŵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��CH3CH2CH2Br�Ʊ�CH3CH(OH)CH2OH������(��������)�����ķ�Ӧ���ͺͷ�Ӧ��������ȷ����(����)
| ѡ�� | ��Ӧ���� | ��Ӧ���� |
| A | �ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ | KOH����Һ/���ȡ�KOHˮ��Һ/���ȡ����� |
| B | ��ȥ��Ӧ���ӳɷ�Ӧ��ȡ����Ӧ | NaOH����Һ/���ȡ����¡�NaOHˮ��Һ/���� |
| C | ������Ӧ��ȡ����Ӧ����ȥ��Ӧ | ���ȡ�KOH����Һ/���ȡ�KOHˮ��Һ/���� |
| D | ��ȥ��Ӧ���ӳɷ�Ӧ��ˮ�ⷴӦ | NaOHˮ��Һ/���ȡ����¡�NaOH����Һ/���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��CH3—CH===CH2��HBr����CH3—CHBr—CH3(��Ҫ����)��1 molij��A���ȼ�պ���Եõ�8 mol CO2�� 4 mol H2O������A�ڲ�ͬ�������ܷ�������ͼ��ʾ��һϵ�б仯��

(1)A�Ļ�ѧʽ��________��A�Ľṹ��ʽ��________��
(2)������Ӧ�У�����________��Ӧ������________��Ӧ��(�Ӧ����)
(3)д��C��D��E��H���ʵĽṹ��ʽ��
C____________________��D________________________________________________________________________��
E____________________��H________________________________________________________________________��
(4)д��D����F��Ӧ�Ļ�ѧ����ʽ__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£�ˮ��Һ��H+��OH-��Ũ�ȱ仯������ͼ2������˵����ȷ����
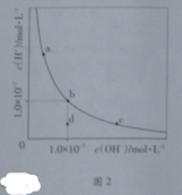
A�������¶ȣ�����������c��b�ı仯
B�����¶��£�ˮ�����ӻ�����Ϊ1��0��10-13
C�����¶��£�����FeCl3����������b��a�ı仯
D�����¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й�����Ȼ���е�ѭ��������ͼ����˵������ȷ���ǣ�
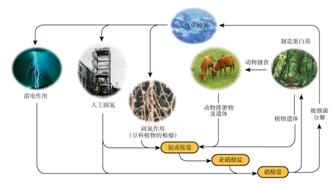
A����Ԫ�ؾ�������
B����ҵ�ϳɰ������˹��̵�
C����������ͺ����л�����ת��
D��̼���⡢������Ԫ��Ҳ�����˵�ѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�о�CO2�ں����е�ת�ƺ��ޣ��ǵ������ѧ�о���ǰ������
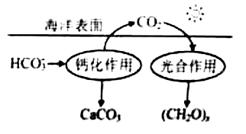
��1�����ں�ˮ��CO2��Ҫ��4����̼��ʽ���ڣ�����HCO3-ռ95%��д��CO2����ˮ����HCO3 -�ķ���ʽ�� ��
-�ķ���ʽ�� ��
��2���ں���ѭ���У�ͨ����ͼ��ʾ��;����̼��
��д���ƻ����õ����ӷ���ʽ�� ��
��ͬλ��ʾ�ٷ�֤ʵ��������ͷų���O2ֻ������H2O����18O������ʵĹ�����õĻ�ѧ����ʽ���£����䲹�������� + ===(CH2O)x+x18O2+xH2O
��3����ˮ���ܽ���̼ռ��ˮ��̼��95%���ϣ���ȷ�������о�����̼ѭ���Ļ����������ܽ���̼���ɲ������·�����
�����ᡢ����CO2����N2���ữ��Ļ�˵�д���CO2���ü�Һ���գ�װ��ʾ��ͼ���£��������߿��е�װ�ò�����������������Լ���
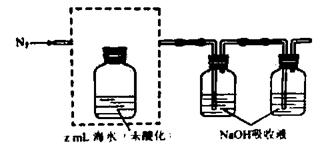
�ڵζ���������Һϴ�����̼ת��ΪNaHCO3������xmol/LHCl��Һ�ζ�������ymlHCl��Һ����ˮ���ܽ���̼��Ũ��=  mol/L��
mol/L��
��4��������ͼ��ʾװ�ôӺ�ˮ����ȡCO2�������ڼ��ٻ����������庬����
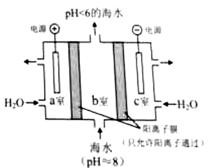
�ٽ�Ϸ���ʽ������ȡCO2��ԭ���� ��
���ø�װ�ò��������ʴ���b���ų��ĺ�ˮ���ϸ���Żش��������ϸ�ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���0.05 mol Na2CO3��������ˮ���100mL��Һ������Һ�м����������ʡ��йؽ�����ȷ����
| ��������� | ���� | |
| A | 50mL 1 mol��L��1H2SO4 | ��Ӧ������c(Na+)=c(SO42��) |
| B | 0.05molCaO | ��Һ�� |
| C | 50mL H2O | ��ˮ�������c(H+)��c(OH��)���� |
| D | 0.1molNaHSO4���� | ��Ӧ��ȫ����ҺpH��С��c(Na+)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ�����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ����
A��0.1mol·L1NaHC2O4��Һ��0.1mol·L1KOH��Һ�������ϣ�������Һ�У�
c(Na)��c(K)��c(C2O42)��c(OH)��c(HC2O4)
B��20mL 0.1 mol·L1NH4Cl��Һ��10mL 0.1mol·L1NaOH��Һ��Ϻ���Һ�ʼ��ԣ�������Һ�У�c(Cl)��c(NH4+)��c(Na)��c(OH)��c(H)
C�������£�pH��2��HF��Һ��pH��12������������Һ�������ϣ�������Һ�У�
c(Na)��c(OH)��c(H)��c(F)
D��0.1mol·L1NH3·H2O��Һ��0.1mol·L1HNO3�������ϣ�������Һ�У�
c(H)��c(OH)��c(NH3·H2O)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com